Для виникнення найпростішої біологічної системи в умовах нашої планети достатньо присутності лише двох видів органічних речовин: нуклеїнових кислот і білків. Структура цих сполук має як риси подібності, так і кардинальні відмінності. Наприклад, вони є биополимерами, знаходяться у всіх без винятку клітинах живих організмів. З’єднання під дією негативних факторів можуть змінювати свою нативну структуру – піддаватися денатурації і деструкції. У нашій статті ми розглянемо, яку роль виконують білки в молекулах складних речовин, наприклад, таких як гликопротеиды і ліпопротеїди. Також вивчимо особливості будови глобулярных білків і наведемо приклади різних їх видів.
Будова пептидів
Гігантські розміри білків (у порівнянні з величиною інших клітинних органічних речовин – вуглеводів, жирів, вітамінів і т. д.) пояснюються їх будовою. Всі білки, інакше звані протеїнами, представляють собою складні комплекси – полімери. Вони мають не тільки велику молекулярну масу, але й кілька форм просторового розташування власної макромолекули. Елементарні частинки білкового полімеру – це 20 видів амінокислот, що беруть участь в реакції поліконденсації. Вони з’єднуються між собою за допомогою пептидних зв’язків -CO—NH-, завдяки яким і утворюється найпростіша форма макромолекули. Така структура білків носить назву первинної або лінійної конфігурації. Утворення додаткових, спочатку водневих зв’язків, а потім і дисульфідних містків призводить до появи спіральної та глобулярной форм білка. Третинна конфігурація у формі сферичних молекул – глобул– поширена в живих біосистемах: клітинах, органах, тканинах. Вона може ускладнюватися у вигляді декількох глобул, пов’язаних небелковым компонентом, і утворювати вищу форму організації – четвертинну структуру.
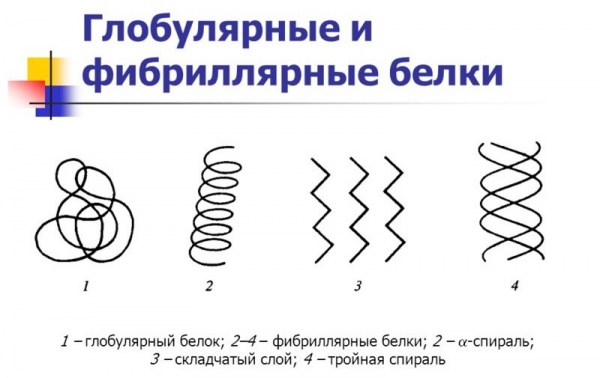
Гемоглобін
У систему рідких середовищ організму входить кров. Її головна функція – це транспорт різних сполук. Крім поживних речовин, наприклад глюкози, що міститься в кров’яній плазмі, до клітин надходить кисень, а видаляється з них вуглекислий газ. Молекули O2 з’єднуються зі спеціальним білком – гемоглобіном – і далі, в зв’язаному стані, розноситься до клітин. Кисень необхідний їм для процесу дихання, яке полягає в окисленні органічних речовин. Гемоглобін являє собою глобулярный білок, який складається з чотирьох амінокислотних ланцюгів. Вони утримуються разом завдяки небелковому компоненту, який називається гемом і містить іон заліза. Комплекс кисню і протеїну називається оксигемоглобином. У процесах метаболізму в клітинах утворюється побічний продукт розпаду – вуглекислий газ. Його молекули також здатні з’єднуватися з гемоглобіном, утворюючи карбоксигемоглобін. Вуглекислий газ надходить в органи дихання і шляхом дифузії, потім видаляється з організму під час видиху.
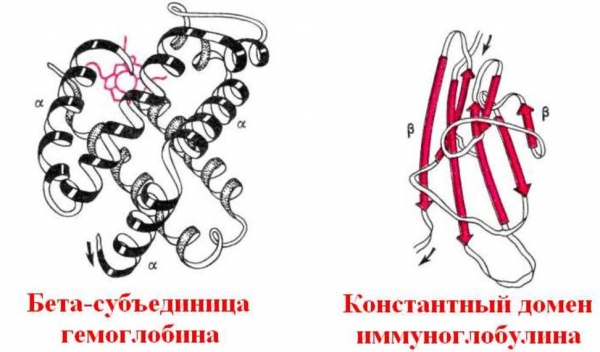
Властивості білків глобулярных
В основі гуморального види імунітету лежить здатність специфічних білків до виконання функції захисту клітин, органів і тканин від ушкоджуючої дії патогенної мікрофлори і микрофауны: вірусів, бактерій, найпростіших, грибків і т. д. Глобулярні білки-антитіла взаємодіють як з самими збудниками, так і з їх токсинами за принципом “ключ – замок”. Антитіла включаються в обмін речовин бактерії або вірусу і блокують його. Чим вище спорідненість захисних протеїнів та їх специфічність, тим швидше антитіла знищують патогенні фактори. Людство успішно бореться з такими тяжкими захворюваннями, як правець, кір або дифтерія, вводячи здоровим людям, котрі побували в контакті з хворими, уже готові антитіла у вигляді сироваток. Ці речовини отримують із крові попередньо заражених тварин: свиней, корів або мавп, що містить антитіла. Сироватка має в своєму складі необхідний захисний глобулярный білок і допомагає запобігти зараженню або полегшити перебіг уже почалася хвороби.
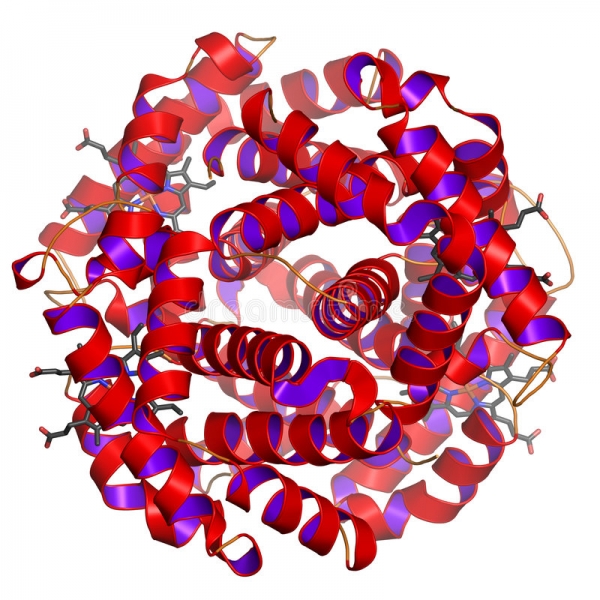
Ферменти
Хімічні реакції в клітинах, на відміну від аналогічно проведених в лабораторії або відбуваються в природі, відбуваються дуже швидко. Пояснюється це участю в них особливих речовин – ферментів або ферментів. Біологічний активатор швидкості певної реакції процесу обміну речовин – це глобулярный білок, що має складне будова. У його складі є специфічне утворення – активний центр, зв’язується з субстратом реакції. Він і впливає на швидкість процесу, що відбувається з речовиною. Всі ферменти специфічні і впливають лише на певний хімічний процес.
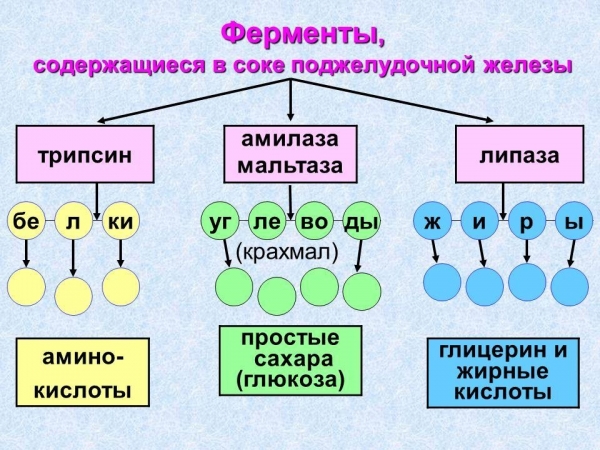
Класифікація
Протеїни, що мають кулясту форму молекули і впливають на протікання реакцій асиміляції і дисиміляції, можна розділити на кілька видів. Критеріями будуть типи реакції, форма та локалізація ферментів у клітині. До глобулярным білків відноситься клас ферментів: пепсин, амілаза, глутаминсинтетаза, синтаза жирних кислот і т. д. Наведемо кілька прикладів.
Види і функції глобулярных протеїнів
Пепсин здійснює розщеплення харчових білків у шлунку в процесі енергетичного обміну. Він синтезується слизовим шаром клітин шлункових, що складається з залозистого епітелію. Амілаза, на відміну від пепсину, міститься не тільки в організмі людини або тварин, але і у рослин. У них фермент утворюється в момент проростання насіння, синтезируясь у вічках зародка. Він і прискорює розщеплення крохмалю до глюкози, необхідної для проростання насіння. У ссавців амілаза входить до складу панкреатичного соку і розщеплює складні вуглеводи. Синтаза жирних кислот – це великий фермент цитоплазми, що забезпечує синтез жирів і вищих жирних кислот.
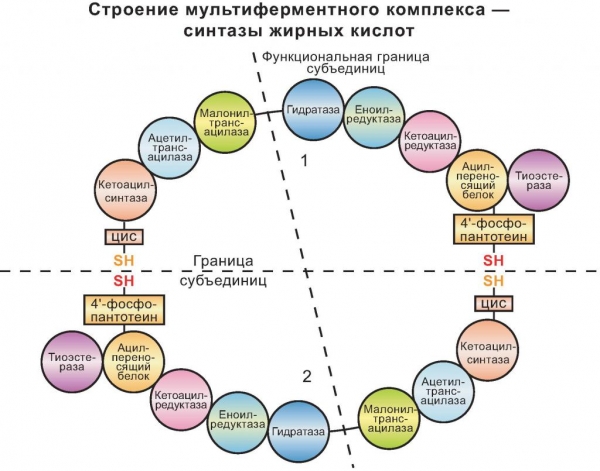
У нашій статті ми вивчили будову і властивості глобулярных білків.












