Коротко розповісти про те, що таке вуглець, неможливо. Адже він – основа життя. Даний елемент є у всіх органічних сполуках, і тільки він може формувати молекули ДНК з мільйонів атомів. Його властивості численні, так що про нього варто розповісти детальніше.
Формула, позначення, особливості
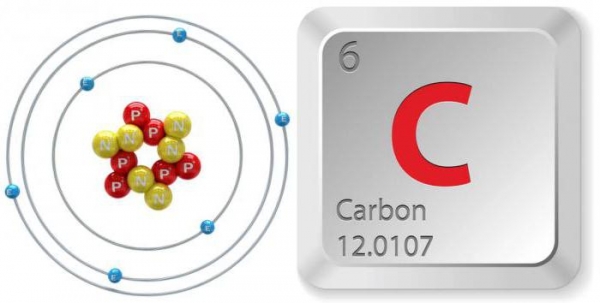
Даний елемент, що знаходиться в таблиці під порядковим номером шість, позначається символом «З». Електронна структурна формула вуглецю виглядає наступним чином: 1s2 2s2 2p2. Його маса – 12,0107 а.е.м. У цієї речовини є:
- Два неспарених електрона в основному стані. Проявляє валентність II.
- Чотири неспарених електрона в збудженому стані. Проявляє валентність IV.
Слід зазначити, що певна маса вуглецю міститься в земній корі. 0,023%, якщо бути точніше. Головним чином він накопичується у верхній частині, в біосфері. Велика частина маси вуглецю літосфери накопичується в доломітах і вапняках, у вигляді карбонатів.
Фізичні характеристики
Отже, що таке вуглець? Це речовина, яка існує у величезному безлічі аллотропних модифікацій, і їх фізичні властивості перераховувати можна довго. А різноманітність речовин обумовлюється здатністю вуглецю до утворення хімічних зв’язків відмінних типів.
Що стосовно властивостей вуглецю, як простої речовини? Їх можна узагальнити наступним чином:
- При нормальних умовах щільність становить 2,25 г/см3.
- Температура кипіння дорівнює 3506,85 °C.
- Молярна теплоємність – 8,54 Дж/(К•моль).
- Критична температура фазового переходу (коли газ не конденсується ні при якому тиску) – 4130 До 12 МПа.
- Молярний об’єм 5,3 см3/моль.
Також варто перерахувати вуглецеві модифікації.
З кристалічних речовин найвідомішими є: алмаз, карбін, графіт, наноалмаз, фуллерит, лонсдейліт, фулерен, а також вуглецеві волокна.
До аморфним утворенням відноситься: деревний, викопний і активоване вугілля, антрацит, кокс, скловуглець, сажа, техвуглець і нанопена.
Але ніщо з перерахованого не є чистою аллотропной формою обговорюваного речовини. Це лише хімічні сполуки, в яких вуглець міститься у високій концентрації.

Структура
Цікаво, що електронні орбіталі атома вуглецю однакові. Вони мають різну геометрію. Все залежить від ступеня гібридизації. Є три найбільш часто зустрічаються геометрії:
- Тетраэдрическая. Вона утворюється, коли відбувається змішання трьох р – і одного s-електронів. Така геометрія атома вуглецю спостерігається у лонсдейліта і алмазу. Аналогічну структуру має метан та інші вуглеводні.
- Тригональная. Цю геометрію утворює змішання двох р – і однієї s-електронної орбіталі. Ще один р-елемент не бере участі в гібридизації, але він задіяний при утворенні π-зв’язки з іншими атомами. Ця структура властива фенолу, графіту та іншим модифікаціям.
- Дигональная. Ця структура утворюється внаслідок змішування s – і р-електронів (по одному). Цікаво, що виглядають електронні хмари, як несиметричні гантелі. Витягнуті вони уздовж цього напрямку. Ще два р-електрона утворюють горезвісні π-зв’язку. Дана геометрія характерна для карбина.
Не так давно, у 2010 році, вчені з університету, який знаходиться в Ноттінгемі, відкрили з’єднання, в якому відразу чотири атома опинилися в одній площині. Його назва – мономерний дилитио метандий.
Молекули
Про них варто сказати окремо. Атоми обговорюваного речовини можуть з’єднуватися, внаслідок чого утворюються складні молекули вуглецю. Від насичених Na, С2 і Н2, між якими є надто слабке тяжіння, їх відрізняє схильність конденсуватися в твердий стан. Молекули вуглецю можуть залишатися в газоподібному стані, тільки якщо підтримувати високу температуру. Інакше речовина миттєво затвердіє.
Деякий час тому в США, в Берклеевской національної лабораторії, була синтезована нова форма твердого вуглецю. Це – С36. І його молекулу утворює 36 вуглецевих атомів. Речовина утворюється разом з фуллеренами С60. Відбувається це між двома електродами графіту, в умовах полум’я дугового розряду. Вчені припускають, що молекули нової речовини володіють цікавими хіміко-електричними властивостями, які поки що не вивчені.

Графіт
Тепер можна більш докладно розповісти про найвідоміших модифікаціях такої речовини, як вуглець.
Графіт – це самородна мінерал із шаруватою структурою. Ось його особливості:
- Він відмінно проводить струм.
- Є відносно м’яким речовиною з-за своєї низької твердості.
- При нагріванні в відсутність повітря проявляє стійкість.
- Не плавиться.
- Жирний На дотик, слизький.
- У природному графіте міститься 10-12% домішок. Як правило, це оксиди заліза і глини.
Якщо говорити про хімічних властивостях, то варто зазначити, що з солями і лужними металами це речовина утворює так звані сполуки включення. Ще графіт при високій температурі реагує з киснем, згораючи до вуглекислого газу. Але ось контакт з неокисляющими кислотами ніякого результату за собою не тягне – це речовина у них просто не розчиняється.
Графіт застосовують в самих різних сферах. Його використовують при виготовленні футерувальних плит і плавильних тиглів, у виробництві нагрівальних елементів і електродів. Без участі графіту неможливо отримати синтетичні алмази. Також він грає роль сповільнювача нейтронів у ядерних реакторах. І, звичайно ж, з нього виготовляють стержні для олівців, заважаючи з каоліном. І це лише частина сфер, де він використовується.

Алмаз
Це метастабільний мінерал, який може існувати необмежену кількість часу, що певною мірою зумовлено міцністю і щільністю вуглецю. Алмаз є самим твердим речовиною за шкалою Мооса, він легко ріже скло.
У нього висока теплопровідність, дисперсія, показник заломлення. Він зносостійкий, а щоб змусити його плавитися, потрібна температура в 4000 °C і тиск близько 11 ГПа. Його особливість – люмінесценція, здатність світитися різними кольорами.
Це рідкісне, хоч і поширена речовина. Вік мінералів, згідно з даними певних досліджень, може коливатися від 100 мільйонів до 2,5 мільярда років. Виявлені алмази позаземного походження, можливо, навіть досолнечного.
Цей мінерал знайшов своє застосування в ювелірній справі. Огранений алмаз називається діамантом, коштує дорого, але статус коштовності і краса зробили його ще більш популярним. До речі, ця речовина також використовують при виготовленні різців, свердел, ножів і т. д. Завдяки своїй винятковій твердості, мінерал застосовують у багатьох виробництвах.

Карбін
В продовження теми про те, що таке вуглець, потрібно кілька слів сказати і про такі її модифікації, як карбін. Він виглядає як чорний дрібнокристалічний порошок, володіє напівпровідниковими властивостями. Отриманий штучним чином на початку 60-х років радянськими вченими.
Особливість цієї речовини полягає у збільшенні під світловим впливом провідності. Саме тому його стали застосовувати у фотоелементах.

Графен
Це перший в світі двовимірний кристал. У даній модифікації велика механічна жорсткість, ніж у графіту, і рекордно висока теплопровідність, складова ~5•103 Вт•м−1•К−. У носіїв заряду графена висока рухливість, саме тому речовина має перспективи в плані його використання в різних додатках. Вважається, що він може стати майбутньою основою наноелектроніки і навіть замінити кремній в інтегральних мікросхемах.
Графен одержують штучно, в наукових лабораторіях. Для цього доводиться вдаватися до механічного відщеплювання графітових шарів від высокоориентированного речовини. Так отримують зразки високої якості з необхідною рухливістю носіїв.
Його властивості вивчені не повністю, але дещо цікаве вчені вже встигли відзначити. Наприклад, в графені немає вингеровской кристалізації. А в подвійному шарі речовини поведінку електронів нагадує те, яке властиве рідким кристалам. Якщо дотримати параметри сколювання на кристалі, вдасться отримати графенових коробчату наноструктуру.

Токсичність
Цю тему варто зазначити на закінчення розповіді про те, що таке вуглець. Справа в тому, що ця речовина виділяється в атмосферу разом з вихлопними газами автомобілів. А ще при спалюванні вугілля, підземної газифікації та в багатьох інших процесах.
Підвищений вміст цієї речовини в повітрі призводить до збільшення чисельності захворювань. Зокрема, це стосується легких і верхніх дихальних шляхів. А токсична дія зумовлена взаємодією радіаційного характеру з β-частинками, яке веде до того, що хімічний склад молекули змінюється і властивості речовини – теж.











