Серед різних класів неорганічних речовин виділяється комплекс бінарних сполук, що складається з трьох груп. Це кислотні, основні та амфотерні оксиди. Їх класифікація і властивості залежать від того, атоми якого хімічного елемента з’єднані з киснем. У нашій статті ми ознайомимося з типовими хімічними реакціями, характерними для оксидів, а також з’ясуємо генетичний зв’язок між ними та іншими класами неорганічних сполук: основами, кислотами та солями.
Особливості основних оксидів
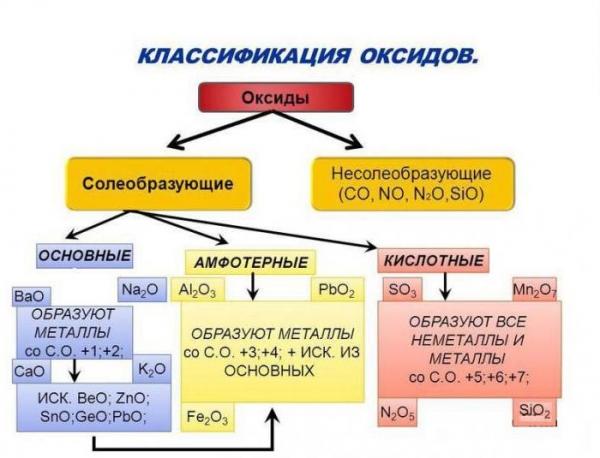
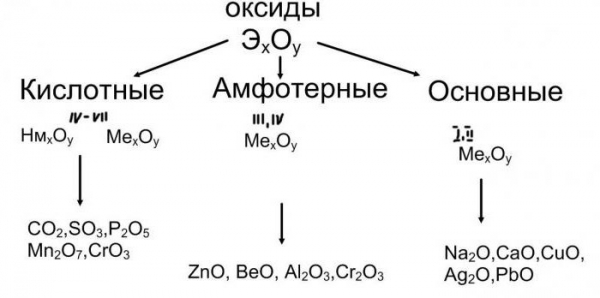
Розглянемо сполуки, до складу яких входять атоми типових металів. Наприклад: CuO, FeO, MgO містять електронейтральні частинки міді, заліза і магнію, значить, це основні оксиди. Їх класифікація і властивості залежать від природи металевого елемента. Якщо в складі речовини присутні атоми лужних або лужноземельних металів, то його молекули здатні взаємодіяти з водою.
Продуктом реакції, що йде з виділенням великої кількості тепла, буде луг, наприклад їдкий натр або гідроксид кальцію. Деякі окисли, такі як оксид міді або заліза, безпосередньо з водою не реагують, тому їх підстави отримують непрямим шляхом: з відповідних солей, що взаємодіють з лугами. Головне ж їх властивість – реагувати з кислотами, утворюючи сіль і воду.
Які оксиди називаються кислотними?
Класифікація і властивості кислот, основ, оксидів, солей визначаються, перш за все, їх здатністю взаємодіяти між собою. Причому з речовин одного класу можна отримати з’єднання іншої групи. Так, з кислотних оксидів в їх реакціях з водою утворюються кислоти. Продуктом гідратації сірчаного ангідриду, наприклад, буде сульфатна кислота, а пропускаючи вуглекислий газ CO2 через воду, отримаємо розчин слабкої вугільної кислоти. Тому кислотні оксиди, їх класифікація та властивості залежать від характеру взаємодії з водою і утворення кислоти. Додамо ще, що в молекулі бінарної сполуки з атомами кисню пов’язані атоми неметалічних елементів. Найважливішим їх властивість буде здатність до реакцій з лугами, продуктами ж будуть сіль і вода.

Чому оксид алюмінія реагує з кислотами і лугами?
Як ви помітили, основні оксиди взаємодіють з кислотами, кислотні оксиди реагують з лугами. Такі з’єднання, як Al2O3 або ZnO – це амфотерні оксиди. Їх класифікація і властивості базуються на здатності цих речовин одночасно вступати в реакцію як з кислотами, так і з активними підставами. При взаємодії оксиду алюмінію, наприклад, з сульфатною кислотою, отримуємо його сульфат. А в реакції цього ж з’єднання з розплавом гідроксиду натрію утворюється сіль – метаалюминат натрію.
Як видно, амфотерні елементи можуть утворювати оксиди, зберігають здатність до реакцій, як з лугами, так і з кислотами. Вони йдуть з утворенням солей. Розглядаючи оксиди, їх класифікацію і властивості, не можна не сказати про ще одній групі цих бінарних сполук. Якщо речовина, наприклад, CO – монооксид вуглецю, або NO – оксид азоту, не може реагувати з кислотами, ні з лугами, то з’єднання здатне утворювати солі. Такі оксиди і називають байдужими або индифферентными. Як ми пам’ятаємо, оксиди є бінарними сполуками, до складу яких обов’язково входить кисень.

Отримання оксидів
Продовжимо розглядати класифікацію, властивості, одержання оксидів. Можна виділити три способи, за допомогою яких сполуки добувають в лабораторії. Найпоширеніший серед них – це окислення простих речовин. Горіння складних сполук, наприклад, природного газу або нафти, – ще один шлях отримання газоподібних оксидів вуглецю і водню. До третього способу ми віднесемо термічне розкладання деяких солей вугільної та нітратної кислот, а також нагрівання нерозчинних у воді підстав, таких як гідроксид міді або заліза. При цьому утворюються оксиди металів і вода.
Взаємодія оксидів між собою
Вивчаючи оксиди, їх класифікацію та хімічні властивості, звернемося до реакцій між речовинами кислотних і основних груп. В результаті їх утворюються сполуки, що відносяться до класу солей. Наприклад, якщо через розчин оксиду кальцію (вапняну воду) пропускати вуглекислий газ, то вона мутніє внаслідок утворення часток нерозчинного карбонату кальцію CaCO3. У промисловості широко застосовують реакції взаємодії кількох речовин: оксидів натрію, кальцію і кремнію. Нагріваючи їх суміш разом з технічною содою, одержують скло.
Особливими характеристиками володіє оксид водню – вода, про них ми поговоримо далі. H2O – найпоширеніше і необхідне з’єднання на Землі. Здатність її молекул до утворення водневих зв’язків забезпечує головні властивості води як універсального розчинника, що володіє специфічними властивостями: високою теплоємністю і теплопровідністю. Вони дуже важливі для процесів обміну речовин в живих організмах.
Вода, як оксид, не реагує з різними кислотними та основними оксидами. У першому випадку отримують кислоти, у другому – луги. Специфічна реакція оксиду водню – здійснювати реакції гідролітичного розкладу (гідролізу). Вони дуже поширені серед речовин органічного походження. Це гідроліз білків, вуглеводів і жирів, що проходить в шлунково-кишковому тракті, розщеплення целюлози мікроорганізмами – сапротрофами і т. д.
Оксиди, основи, солі: класифікація, властивості
Між основними класами неорганічних речовин існує генетичний зв’язок, що доводить можливість їх взаємного перетворення. Так, з основного активного оксиду металу можна отримати підставу, а з нього – сіль. Прикладом такої ланцюжка перетворень служить наступна схема: оксид натрію гідроксид натрію карбонат натрію. Кислотні оксиди служать вихідними сполуками в реакціях з водою. Продукт, який виходить в цьому випадку – кислота. Наприклад: діоксид вуглецю – карбонатна кислота – карбонат натрію.
Реакція кислоти з гідроксидами, яка називається нейтралізацією, призведе до появи солей. В обох випадках кінцевим ланкою генетичної ланцюжка буде з’єднання цього класу, що зв’язує між собою перетворення неметалевих і металевих хімічних елементів. Тому існує і зворотний механізм: від солі – до основ, кислот або до простої речовини.

У даній статті ми розглянули класифікацію та хімічні властивості основних класів неорганічних речовин.











