Органічні основи – таку назву часто використовують у хімії для сполук, які є похідними аміаку. Атоми водню в його молекулі заміщені на вуглеводневі радикали. Мова йде про аміни – з’єднаннях, повторюють хімічні властивості аміаку. У нашій статті ми познайомимося із загальною формулою амінів та їх властивостями.
Будова молекули
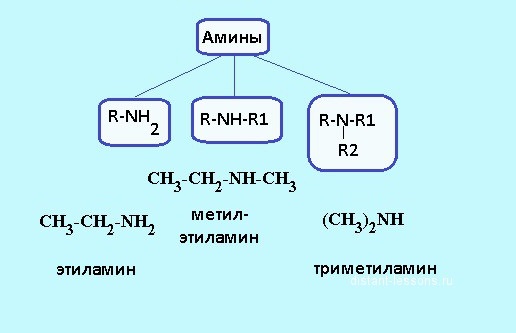
В залежності від того, скільки атомів водню заміщені вуглеводневими радикалами, розрізняють первинні, вторинні і третинні аміни. Наприклад, метиламин – первинний амін, в якому водневу частку замінили групою -CH3. Структурна формула амінів – R-NH2, її можна використовувати, щоб визначити склад органічної речовини. Прикладом вторинного аміну може бути диметиламин, має наступний вигляд: NH2-NH-NH2. У молекулах третинних сполук всі три атоми водню аміаку заміщені вуглеводневими радикалами, наприклад, триметиламін має формулу (NH2)3N. Будова амінів впливає на їх фізичні та хімічні властивості.
Фізична характеристика
Агрегатний стан амінів залежить від того, яка молярна маса радикалів. Чим вона менша, тим нижча питома вага речовини. Нижчі речовини класу амінів представлені газами (наприклад, метиламин). Вони мають добре виражений запах аміаку. Середні аміни – це слабо пахнуть рідини, а сполуки з великою масою вуглеводневої радикала – тверді речовини без запаху. Розчинність амінів також залежить від маси радикала: чим вона більше, тим гірше речовина розчиняється у воді. Таким чином, будова амінів визначає їх фізичний стан і характеристику.
Хімічні властивості
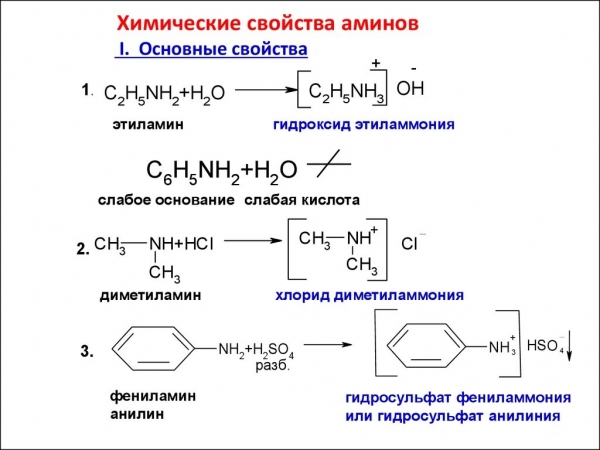
Характеристика речовин залежить в основному від перетворень аміногрупи, в якій провідна роль відводиться її неподіленої електронної пари. Так як органічні речовини класу амінів є похідними аміаку, то вони здатні до реакцій, характерних для NH3. Наприклад, сполуки розчиняються у воді. Продуктами такої реакції будуть речовини, що проявляють властивості гідроксидів. Наприклад, метиламин, атомний склад якого підпорядковується загальній формулі граничних амінів R-NH2, з водою утворює з’єднання – гідроксид метиламмония:
CH3 – NH2 + H2O = [CH3 – NH3]OH
Органічні підстави взаємодіють з неорганічними кислотами, при цьому в продуктах виявляється сіль. Так, метиламин з соляною кислотою дає хлорид метиламмония:
СН3-NH2 + HCl -> [CH3NH3]Cl
Реакції амінів, загальна формула яких – R-NH2, з органічними кислотами проходять з заміщенням атома водню аміногрупи складним аніоном кислотного залишку. Вони називаються реакціями алкілування. Як і в реакції з нитритной кислотою, ацильные похідні можуть утворювати тільки первинні і вторинні аміни. Триметиламін та інші третинні аміни до таких взаємодій не здатні. Додамо також, що алкілування в аналітичної хімії застосовують для розділення сумішей амінів, воно також служить якісною реакцією на первинні і вторинні аміни. Серед циклічних амінів важливе місце належить анилину. Його добувають з відновленням нітробензолу останнього воднем у присутності каталізатора. Анілін є вихідною сировиною для виробництва пластмас, барвників, вибухових і лікарських речовин.

Особливості третинних амінів
Третинні похідні аміаку відрізняються своїми хімічними властивостями від одно – або двухзамещенных сполук. Наприклад, вони можуть взаємодіяти з галогенопроизводными сполуками граничних вуглеводнів. В результаті утворюються солі тетраалкиламмония. Окис срібла вступає в реакцію з третинними амінами, при цьому аміни переходять в гідроксиди тетраалкиламмония, які є сильними підставами. Апротонные кислоти, наприклад бору трифторид, з триметиламином здатні утворювати комплексні сполуки.
Якісна проба на первинні аміни
Реактивом, за допомогою якого можна виявити одне – або двохзаміщені аміни, може служити азотиста кислота. Так як вона не існує у вільному стані, для її отримання в розчині спочатку проводять реакцію між розведеною хлоридною кислотою та нітритом натрію. Потім додають розчинений первинний амін. Склад його молекули можна виразити за допомогою загальної формули амінів: R-NH2. Цей процес супроводжується появою молекул неграничних вуглеводнів, які можна визначити за допомогою реакції з бромною водою або розчином перманганату калію. Якісної можна вважати і изонитрильную реакцію. В ній первинні аміни взаємодіють з хлороформом в середовищі з надмірною концентрацією аніонів гидроксогрупп. У результаті відбувається утворення изонитрилов, що володіють неприємним специфічним запахом.

Особливості реакції вторинних амінів з нитритной кислотою
Технологія отримання реактиву HNO2 описана нами вище. Потім до розчину, що містить реактив, додають органічне похідне аміаку, що містить два вуглеводневих радикала, наприклад, діетиламін, молекула якого відповідає загальній формулі вторинних амінів NH2-R-NH2. В продуктах реакції знаходимо нитросоединение: N-нитрозодиэтиламин. Якщо на нього подіяти хлоридною кислотою, то з’єднання розкладається на хлоридну сіль вихідного аміну і хлористий нитрозил. Додамо ще, що третинні аміни не здатні до реакцій з азотистої кислотою. Це пояснюється наступним фактом: нитритная кислота відноситься до слабких кислот, і її солі при взаємодії з амінами, що містять три вуглеводневих радикала, у водних розчинах повністю гідролізуються.
Способи отримання
Аміни, загальна формула яких – R-NH2, можна добути відновленням сполук, що містять азот. Наприклад, це може бути відновлення нитроалканов в присутності каталізатора – металічного нікелю – при нагріванні до +50 ⁰C і при тиску до 100 атм. Нитроэтан, нітропропан або нітрометан в результаті цього процесу перетворюються в аміни. Речовини цього класу можна отримати і відновленням воднем сполук групи нітрилів. Дана реакція проходить в органічних розчинниках, при цьому необхідно присутність нікелевого каталізатора. Якщо в якості відновника використовують металевий натрій, в цьому випадку процес здійснюється в спиртовому розчині. Наведемо в якості прикладів ще два методу: амінування галогеноалканов і спиртів.
У першому випадку утворюється суміш амінів. Амінування спиртів здійснюється наступним способом: суміш парів метанолу або етанолу з аміаком пропускають над окисом кальцію, що виконує роль каталізатора. Утворюються первинні, вторинні і третинні аміни зазвичай можна розділити розгоном.
У нашій статті ми вивчили будову і властивості азотовмісних органічних сполук – амінів.











