Перш ніж розповісти про властивості білків, варто дати коротке визначення даного поняття. Це високомолекулярні органічні речовини, які складаються із сполучених пептидного зв’язком альфа-амінокислот. Білки є важливою частиною харчування людини і тварин, оскільки не всі амінокислоти виробляються організмом – деякі надходять саме з їжею. Які ж їхні властивості та функції?
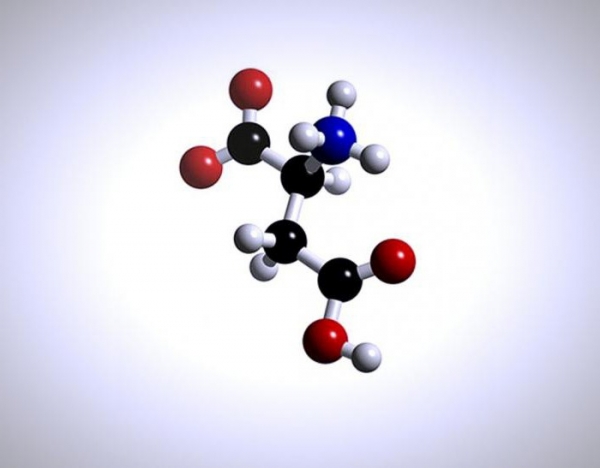
Амфотерність
Це перша особливість білків. Під амфотерностью розуміється їх здатність проявляти як кислотні, так і основні властивості.
Білки у своїй структурі мають кілька видів хімічних угруповань, які здатні іонізувати в розчині Н2О. До таких належать:
- Карбоксильні залишки. Глутамінова і аспарагінова кислоти, якщо бути точніше.
- Азотовмісні групи. ε-аміногрупа лізину, аргининовый залишок CNH(NH2) і имидазольный залишок гетероциклической альфа-амінокислоти під назвою гістидин.
У кожного білка є така особливість, як изоэлектрическая точка. Під даним поняттям розуміють кислотність середовища, при якій поверхня або молекула не має електричного заряду. За таких умов зводиться до мінімуму гідратація і розчинність білка.
Показник визначається співвідношенням основних і кислих амінокислотних залишків. У першому випадку крапка припадає на лужну область. У другому – на кислу.