Роль дейтерію в природі
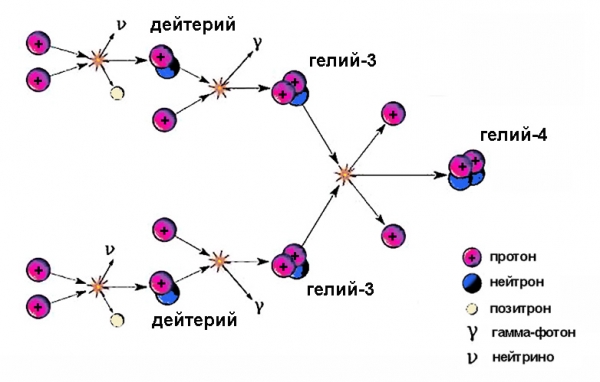
Ядра важкого водню беруть участь у проміжних стадіях термоядерного циклу. Сонце світить завдяки цьому процесу, на одному з етапів якого утворюється ізотоп водню дейтерій, зливаючись з протоном, породжує гелій-3.
Вода, в склад якої входить, крім протію, один атом дейтерію, називається напівважкій і має формулу HDO. В молекулі важкої води D2O дейтерій повністю замінює легкий водень.
Важка вода характеризується уповільненим перебігом хімічних реакцій, внаслідок чого у великих концентраціях вона шкідлива для живих організмів, особливо вищих, таких як ссавці і в тому числі осіб. Якщо в складі води чверть водню заміщена дейтерієм, тривале вживання її загрожує розвитком безпліддя, анемії і інших захворювань. При заміщенні 50% водню ссавці гинуть через тиждень вживання такої води. Що стосується короткочасних підвищень концентрації важкого водню у воді, вона практично нешкідлива.

Як отримують важкий водень
Найзручніше отримувати цей ізотоп у складі води. Є кілька способів збагачення води дейтерієм:
- Ректифікація – процес розділення сумішей на компоненти, що киплять при різній температурі. Поділ досягається через багаторазове випаровування і конденсацію суміші ізотопів в рідкому водні воді або на спеціальному обладнанні – ректифікаційних колонах, в яких потоки газоподібної і рідкої фаз йдуть у зустрічних напрямках.
- Електролітичне поділ. Метод заснований на тому, що при електролізі води від її молекул більш активно відщеплюється легкий ізотоп. Електроліз проводять в декілька етапів.
- Іонний ізотопний обмін, при якому відбувається взаємне заміщення іонів різних ізотопів у складі реагентів. В даний час цей спосіб з використанням води та сірководню в якості реагуючих компонентів є найбільш ефективним і економічним.