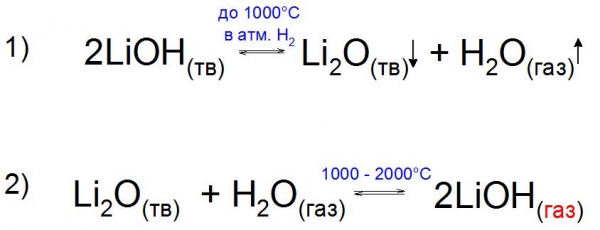Фізичні властивості
Чистий LiOH – дуже їдка речовина, здатне зруйнувати скло і фарфор, тому його зберігають в парафинированных судинах. У розплавленому стані його можна отримати тільки в нікелевих або срібних посудинах, так як він окисляє більшість металів і сплавів. Золото є одним з небагатьох речовин, стійких до впливу такого з’єднання.
Сама підстава, порівняно з оксид Li2O, хімічно хитке і вже ближче до 1000 °C в атмосфері водню H2 розкладається на складові (приклад 1).
Оксид літію і гідроксид літію в хімічно чистому стані є твердими речовинами, щодо розчинні у воді, але менше (майже в 5 разів), ніж аналогічні з’єднання наступних представників групи. Найвища точка розчинення у описуваного підстави доводиться при 100 °C – 17,5 г/100 г розчинника, тоді як, наприклад, у гідроксиду натрію (NaOH) – 337 г/100 г і продовжує зростати з підвищенням температури. У той же час розчинність гідроксиду літію практично в 100 разів більше розчинності гашеного вапна (Ca(OH)2), у якої така здатність знижується з підвищенням температури.
Цікаво, що експериментально вдалося отримати газоподібний LiOH у присутності парів води. Його отримують шляхом нагрівання оксиду Li до 2000 °C, коли після рубежу в 1000 °C тиск пари цього з’єднання збільшується за рахунок утворення стійкого спорідненого підстави (приклад 2).