Люди звикли до води і вважають її звичайною речовиною. Вони часто сприймають її як щось само собою зрозуміле до тих пір, поки засуха не почне загрожувати посівам і запасам питної води, або сильна повінь не створить загрозу життю і майну. Багато хто не усвідомлюють, що структура води та її аномальні властивості забезпечують існування життя на Землі.
Один з ранніх грецьких філософів, Фалес Мілетський (640-546 рр. до н. е.), досліджував універсальний характер води. Він вважав її основним елементом, з якого народжується все. Велика кількість води було очевидним, але Фалес помітив, що вона є єдиною речовиною, природним чином присутнім на Землі одночасно в трьох різних станах: твердому, рідкому і газоподібному. У холодний зимовий день сніг і лід покривають поля, поруч тече річка, а над головою пливуть хмари.
Форми матерії
Всі речовини існують в трьох різних станах, які залежать від температури і тиску. Тверді тіла володіють певною формою і мають внутрішню кристалічну структуру. З цього визначення речовина, подібне склу, буде вважатися високов’язкої рідиною, оскільки воно не володіє кристалічною будовою. Тверді тіла схильні протистояти зовнішнім впливом. Вони можуть бути перетворені в рідину шляхом нагрівання. Температура замерзання води при тиску в 1 атмосферу дорівнює 0 °С, нижче якої вона існує у вигляді льоду.
Рідина, на відміну від твердого тіла, не володіє твердістю і не має певної форми. У неї є обсяг, і вона приймає форму посудини, в якій зберігається. Зовнішній вплив змушує її текти. Вода являє собою рідину між температурами замерзання і кипіння (100 °С). Рідини можуть переходити в газоподібну фазу при нагріванні вище точки кипіння.
Газ не має ні форми, ні певного обсягу. Він приймає форму і займає об’єм посудини, в якій знаходиться. Газ розширюється і стискається зі зміною температури і тиску і здатний легко дифундувати в інші гази.

Точки кипіння і замерзання
Аномальними властивостями води є її незвично високі температури кипіння і замерзання порівняно з іншими сполуками з аналогічною молекулярною структурою. Інші подібні речовини у звичайних умовах є газами. Очікується, що вода з більш низькою молекулярною масою, ніж аналогічні з’єднання, повинна мати більш низькі температури кипіння і замерзання. Однак з-за полярної природи її молекули і водневих зв’язків температура її кипіння дорівнює 100 °C, а замерзання – 0 °C. Для порівняння, відповідні значення у сірководню H2S рівні -60 °C і -84 °C, у селеноводорода H2Se цей показник становить -42 °C і -64 °C і у теллуроводорода -2 °C і -49 °C.
Тверда фаза
Як правило, з пониженням температури речовини стають більш щільними, і вода не є винятком. Її щільність при 25 °C дорівнює 0,997 г/мл і збільшується до максимальної (1 г/мл) при T = 4 °C. В метричній системі вимірювання кілограм визначається як маса 1 л води з максимальною щільністю. Між 4 °C і точкою замерзання 0 °C відбувається дивовижна річ, яка спостерігається у дуже невеликого числа речовин. Вода поступово розширюється, стаючи менш щільною. Щільність льоду при 0 °C становить близько 0,917 г/мл Молекули води утворюють кристали у формі тетраедра (чотиристоронньої фігури, кожна грань якої являє собою рівносторонній трикутник). Оскільки щільність твердої фази менше, ніж рідкої, лід плаває. При заморожуванні об’єм води збільшується на 1%.
Дуже важливо, що лід розширюється і плаває на поверхні. З-за цього взимку лопаються водопроводи і з’являються вибоїни на дорогах. Замерзання і танення води значною мірою відповідально за руйнування скель і утворення ґрунтів. Крім того, якщо б озера і потоки замерзали знизу вгору, то водна життя взагалі перестала б існувати, а кліматичні і погодні умови різко змінилися.

Теплоємність
Ще одним аномальним властивістю води є її надзвичайно висока здатність поглинати тепло без значного підвищення температури. Наприклад, літнє сонце на пляжі нагріває пісок до такої міри, що стає неможливо по ньому ходити. Вода при цьому залишається прохолодною. Обидві речовини поглинають рівну кількість теплової енергії, але температура піску вище. Порожній залізний казанку, що висів над вогнем, швидко розжариться до червоного, але якщо він заповнений водою, то його нагрів відбувається поступово. Висока теплоємність води робить її доброю охолоджувальною рідиною в конденсаторах і автомобільних радіаторах, що запобігають двигуни від перегріву. Її значення в 5 разів перевищує теплоємність піску і приблизно в 10 разів – заліза.
Помірний клімат в прибережних районах є результатом поглинання протягом дня величезної кількості сонячної теплової енергії водою і повільного вивільнення її вночі. Внутрішні райони далеко від узбережжя зазвичай відчувають набагато більш високі екстремальні температури. Величезні океани на Землі (близько 75% площі поверхні) відповідають за пом’якшення клімату на нашій планеті, підтримуючи існування життя.
Теплота плавлення і випаровування
З теплоємністю пов’язана теплота фазового переходу. Це кількість теплової енергії, що поглинається або вивільненої речовиною, яка змінюється в фазі (від рідкого до твердого стану, або навпаки, і від рідкого до газоподібного, або навпаки) без зміни температури. Надзвичайно високі значення питомої теплоти плавлення (332,4 кДж/кг) і випаровування (2256,2 кДж/кг) – чергові аномальні фізичні властивості води. При замерзанні виділяється така ж кількість тепла, що поглинається в процесі плавлення.

Практичним прикладом використання питомої теплоти плавлення води є використання льоду для охолодження напоїв в ізольованому кулері. В процесі танення лід поглинає теплову енергію напоїв, зберігаючи їх прохолодними. Ємність з водою в теплиці в холодну зимову ніч пом’якшить температуру в приміщенні з-за тепла, що виділяється при замерзанні. Конденсація пари вивільняє те ж кількість тепла, що поглинається в процесі випаровування. Питома теплота випаровування в 5 разів перевищує теплоту, необхідну для підвищення температури від 0 до 100 °C. Аномальне властивість води зберігати велику кількість накопиченої теплової енергії робить парове опалення ефективним. В процесі конденсації пар вивільняє накопичену теплову енергію. Гроза денна в спекотний літній день – ще один приклад вивільнення теплової енергії у верхніх шарах атмосфери при конденсації гарячого вологого повітря. Навіть ураган є прикладом впливу перерозподілу величезної кількості теплової енергії, поглиненої тропічними океанами.
Системи випарного охолодження працюють навпаки. Вода в процесі випаровування поглинає теплову енергію з повітря, охолоджуючи його.
Універсальний розчинник
Розчинник здатний розчиняти інша речовина з утворенням гомогенної суміші (розчину) на молекулярному рівні. Ще одним аномальним властивістю води у хімії завдяки її полярної природи є її здатність розчиняти інші полярні сполуки – солі, спирти, карбоксильні з’єднання і т. д. У воді розчиняється більше речовин, ніж в будь-якому іншому розчиннику. У ній можна знайти більше половини відомих хімічних елементів, деякі у високих концентраціях, а інші – тільки в слідових кількостях. Наприклад, концентрація насичення хлориду натрію становить близько 36 г на 100 мл, а карбонату кальцію – близько 0,0015 р. Здатність води розчиняти речовина залежить від його хімічного складу, сили хімічних зв’язків елементів, температури і рН.
Неполярні сполуки, в тому числі більшість вуглеводнів, розчиняються в низьких або слідових кількостях. Наприклад, масла, як правило, плавають на поверхні води.

Поверхневий натяг
До аномальних властивостей води відносять і її найвища (після ртуті) поверхневий натяг у порівнянні з будь-якою іншою рідиною. Це сила тяжіння молекул, розташованих під поверхнею і тих, які знаходяться на межі розділу рідина-повітря. Вона утримує воду від розтікання. Полярні сполуки, як правило, мають набагато більш високий поверхневий натяг, ніж неполярні. І вода не є винятком. При 20 °С цей показник дорівнює 0,07286 Н/м (у етилового спирту – 0,0228 Н/м).
Без зовнішнього впливу крапля H2O приймає форму сфери, оскільки ця фігура володіє найменшою площею поверхні на одиницю об’єму. Краплі дощу є крихітними кулями, які при тривалому впливі руйнують гірські породи. З цієї ж причини об’єкти, більш важкі, ніж вода, можуть утримуватися на її поверхні. Комахи здатні ходити по ній, а лезо бритви – плавати.
Водневий зв’язок визначає анормальний властивість води змочувати більшість поверхонь. Такі речовини вважаються гідрофільними. Вода здатна підніматися по стінках склянки та інших ємностей. Інші речовини, такі як масло, жири, віск і синтетика (поліпропілен і т. д.), не намокають. Вони є гідрофобними. Мембранні фільтрувальні картриджі з розміром пор менше 1 мкм виготовляють з гідрофобних полімерів за допомогою змочують агентів, що знижують поверхневий натяг води, щоб остання могла проникнути і залишатися в них. Це явище називається капілярний ефект. Він відповідає за рух води в ґрунті і по корінню рослин і крові по кровоносних судинах.

Аномальні властивості води та їх значення для життя
H2O є невід’ємним компонентом існування всього живого. Це пояснює недавній інтерес до виявлення води в інших частинах Всесвіту. Всі відомі біохімічні процеси відбуваються у водному середовищі. Більшість живих істот містять 70-80% H2O по вазі.
Крім того, вода відіграє значну роль в процесі фотосинтезу. Рослини використовують променисту енергію сонця для перетворення води і вуглекислого газу у вуглеводи: 6CO2 + 6H2O + 672 ккал → C6H12O6 + 6O2. Фотосинтез – основна і найважливіша хімічна реакція на Землі. Він постачає поживні речовини, прямо або побічно, всім живим організмам і є основним джерелом атмосферного кисню.
Аномальні властивості води та їх причини
Здатність елементів формувати з’єднання залежить від здатності їх атомів віддавати або приймати електрони. Елементи першого типу стають позитивно зарядженими іонами (катіонами), а другого – негативно зарядженими аніонами.
Здатність елемента взаємодіяти з іншими елементами для утворення сполук називається валентністю. Вона відповідає кількості отриманих або відданих електронів. Для неорганічних сполук алгебраїчна сума валентних чисел елементів дорівнює нулю. Електростатичне тяжіння протилежно заряджених іонів з утворенням сполуки називається іонним зв’язком.
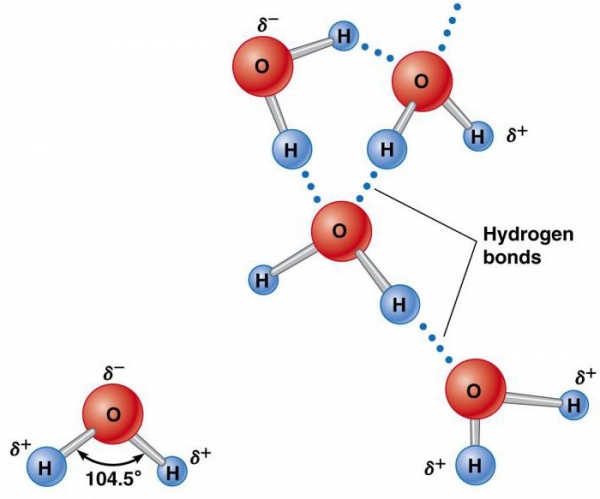
Елементи, які утворюють воду (водень і кисень), існують окремо у молекулах H2 і O2, що містять по два атома. Вони утримуються разом завдяки обміну електронною парою в хімічній зв’язку, званої ковалентного. Вона набагато сильніше іонної. Два атома, утримувані разом ковалентним зв’язком, утворюють набагато більш стійку молекулу, ніж її складові частини. В ній водень об’єднується киснем за допомогою спільних електронних пар. Це унікальне розподіл електронів в утвореному хімічному з’єднанні змушує атоми H розташовуватися по відношенню до O під кутом 104,5°.
Аномальні фізичні властивості води пояснюються її структурою та хімічної зв’язком.
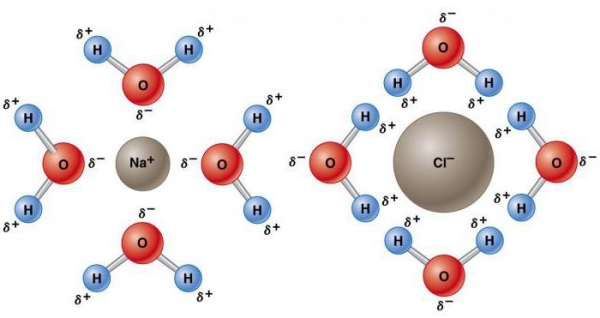
Атом кисню має відносно сильне вплив на загальну пару електронів, у результаті чого атоми водню стають электроположительными, а атом кисню – электроотрицательной областю. Оскільки позитивно і негативно заряджені ділянки розподілені нерівномірно по відношенню до центральної точки, молекула води є полярною.
Така її природа змушує її ставати електростатично привабливою для інших молекул H2O, а також іонів і контактних поверхонь з зарядженими ділянками. Електропозитивні атоми водню притягаються до електронегативний атомів кисню сусідніх молекул води. Це явище називається водневої зв’язком. Її міцність складає всього близько 10% ковалентного, але вона відповідає за більшість аномальних фізичних властивостей води. До них відносяться високі температури замерзання і кипіння, теплоємність, питома теплота плавлення і випаровування, розчинність і поверхневий натяг.
Воднева зв’язок відповідає за підтримку цілісності молекули H2O під час хімічних реакцій. У той час як інші сполуки піддаються іонізації, сама вода зберігає свою хімічну цілісність. Лише відносно невелике число молекул іонізується в водень і гідроксильні іони. Тому H2O є відносно поганим провідником електричного струму. Специфічне опір теоретично чистої води становить 18,3 МОм∙см, в той час як питна має питомий опір менше 10 000 Ом∙див. Таким чином можна легко перевірити чистоту H2O.
Аномальні властивості води пояснюються наявністю водневих зв’язків, за яких має місце низька щільність льоду. Уздовж них при замерзанні розташовуються молекули, що призводить до розширення речовини. З цієї причини лід плаває на поверхні води. Підвищений тиск знижує температуру плавлення. Тиск, створюваний лезом ковзана, топить лід, створюючи шар, що забезпечує витончене ковзання. Навіть при надзвичайно низьких температурах високий тиск послаблює кристалічну решітку. Це є причиною того, що величезні крижані маси, такі як льодовики, поступово рухаються.
Дипольний момент
Полярна природа молекули води змушує її орієнтуватися в електричному або магнітному полі. Електронегативний атом кисню вибудовується до позитивного полюса, а електропозитивні атоми водню – до негативного напрямку. Вода має виключно великий дипольний момент, який представляє собою добуток відстані між зарядами, помножена на величину заряду.
Діелектрична проникність є ще однією властивістю, пов’язаною з дипольним моментом. Молекули води шляхом вирівнювання в електричному полі прагнуть нейтралізувати його і створити стійкість до передачі електростатичного заряду. Діелектрична проникність речовини визначається ε в рівнянні F = Q1∙Q2/ε∙r2, де F – сила між двома зарядами Q, розділені відстанню r в середовищі.
По мірі збільшення діелектричної проникності сила між зарядами зменшується. Висока діелектрична постійна зменшує силу притягання іонів, що пояснює аномальні хімічні властивості води розчиняти різноманітні речовини.
Висновок
Для людей вода – це звичайна речовина, яка часто приймається як належне. Незважаючи на те, що аномальні властивості води пояснюються на атомному рівні, її значення дійсно велика. Очевидно, що вона необхідна для існування життя на Землі. Аномальні властивості води, коротко кажучи, дозволяють їй служити медіатором хімічних і біохімічних процесів, формувати наше природне середовище і брати участь у створенні клімату і погоди.