Хімічні властивості
Гідроксид літію кислотою не вважається, оскільки не є амфотерным елементом і не виявляє здатності до розпаду за типом MeOH ↔ MeO- + H+ (де Me – будь-який метал I або II групи основної підгрупи), як і інші представники лужних металів. Про такі з’єднання кажуть, що вони є дуже сильними підставами, так як константа їх дисоціації за принципом MeOH ↔ Me+ + OH – дуже висока (Кb, LiOH = 6,75 · 10-1).
Оскільки подібне з’єднання виявляє сильні основні властивості, що воно може вступати в реакції нейтралізації з кислотами, кислотними оксидами і обміну з різними солями (приклад 3).
Також характерною реакцією є взаємодія холодних і гарячих концентрованих розчинів гідроксиду літію з газоподібним хлором з утворенням гипохлоритов і хлоратів літію (приклад 4).
Особливістю даної підстави є взаємодія з гарячим розчином перекису водню H2O2 з утворенням кристалогідрату перекисного літію Li2O2 в середовищі етанолу, що розділяється в вакуумі (приклад 5).
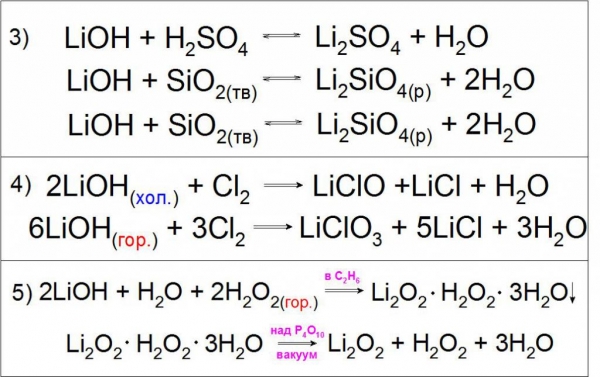
Отримання
LiOH отримують різними способами, одним з яких є безпосередня взаємодія металу або його оксиду з водою за схемою літій → оксид літію → гідроксид літію.

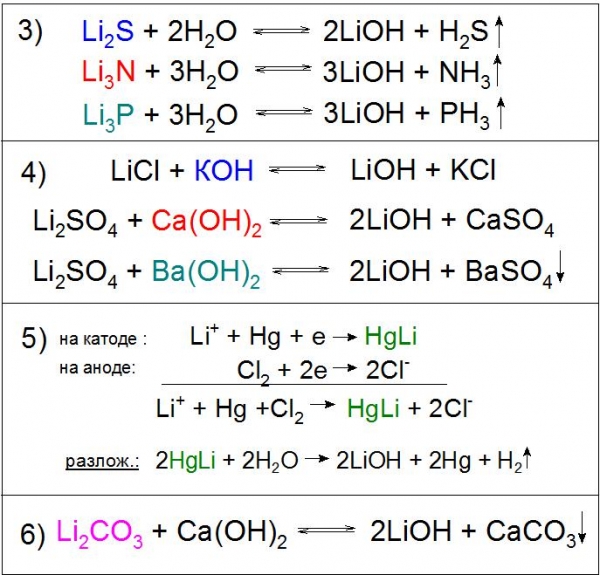
Також застосовується гідроліз сульфіду, нітриду, фосфидов та інших сполук (приклад 3).
Реакції обміну розчинів солей літію можливі практично з будь-якими підставами, наприклад гідроксидом калію (КОН), кальцію (Ca(OH)2) і барію (Ba(OH)2), причому з останнім реагентом хімічна взаємодія йде практично до кінця з сульфатом Li. У першому і другому випадку реакція буде виправдана за рахунок поганої розчинності одержуваних солей в розчині LiOH (приклад 4), а в третьому – до цього додасться нерозчинна у воді BaSO4 (приклад 4). Варто відзначити, що останній варіант не використовується на виробництві з економічних міркувань.
Ще одним примітним методом отримання даної сполуки є електроліз розчину хлориду літію LiCl на ртутному катоді. При цьому утворюється амальгама HgLi, цікава тим, що температура її плавлення значно вища (609 °C), ніж будь-якого його компонента. У процесі розкладання водою отриманого з’єднання утворюється необхідну основу (приклад 5).
Особливе промислове значення має реакція розкладання карбонату літію гашеним вапном, в ході якого хімічна рівновага штучно зсувається праворуч для більш високого виходу основного продукту (приклад 6).