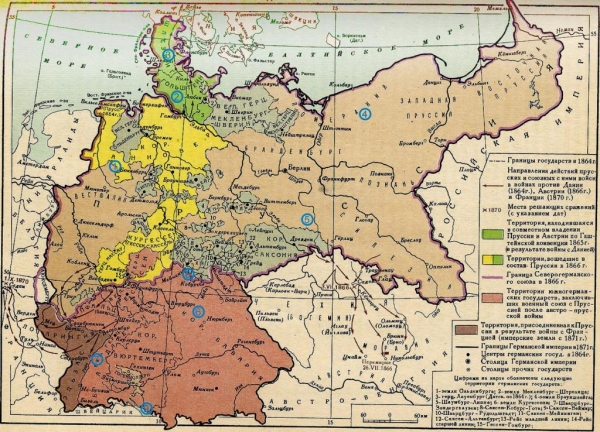
Що таке гідроксид літію? Це з’єднання є одним з найважливіших термостійких сполук, використовуваних у виробництві для одержання різних солей літію. Іони цього елемента володіють рядом характерних особливостей, які знайшли своє широке застосування в хімічному виробництві.
Особливості будови атома літію
Літій (Li) є елементом I групи основної підгрупи 2-го періоду, і належить до групи лужних металів. Його часто називають перехідним до щелочноземельным елементів, оскільки він має трохи меншу активність, ніж наступні представники цієї групи, наприклад, натрій (Na) або калій (K).
Атом літію має найменшим радіусом серед усіх лужних металів, що обумовлює його хімічну активність. Також особливу роль відіграє попередня валентному електрону 2s1 стійка електронна оболонка 1s2 типу гелію, яка створює високу поляризовність частинки.
Це властивість літію характеризує виникнення електромагнітних або дипольних полів навколо атома, що дозволяє створювати міцні комплексні іони кшталт [Li(NH3)n]+. Варто відзначити, що при таких властивостях сам атом не схильний поляризації, що пояснює термічну нестійкість деяких його солей, особливо з комплексними аніонами.
Всі перераховані вище факти пояснюють деякі особливості фізичних і хімічних властивості гідроксиду літію (LiOH).

Фізичні властивості
Чистий LiOH – дуже їдка речовина, здатне зруйнувати скло і фарфор, тому його зберігають в парафинированных судинах. У розплавленому стані його можна отримати тільки в нікелевих або срібних посудинах, так як він окисляє більшість металів і сплавів. Золото є одним з небагатьох речовин, стійких до впливу такого з’єднання.
Сама підстава, порівняно з оксид Li2O, хімічно хитке і вже ближче до 1000 °C в атмосфері водню H2 розкладається на складові (приклад 1).
Оксид літію і гідроксид літію в хімічно чистому стані є твердими речовинами, щодо розчинні у воді, але менше (майже в 5 разів), ніж аналогічні з’єднання наступних представників групи. Найвища точка розчинення у описуваного підстави доводиться при 100 °C – 17,5 г/100 г розчинника, тоді як, наприклад, у гідроксиду натрію (NaOH) – 337 г/100 г і продовжує зростати з підвищенням температури. У той же час розчинність гідроксиду літію практично в 100 разів більше розчинності гашеного вапна (Ca(OH)2), у якої така здатність знижується з підвищенням температури.
Цікаво, що експериментально вдалося отримати газоподібний LiOH у присутності парів води. Його отримують шляхом нагрівання оксиду Li до 2000 °C, коли після рубежу в 1000 °C тиск пари цього з’єднання збільшується за рахунок утворення стійкого спорідненого підстави (приклад 2).
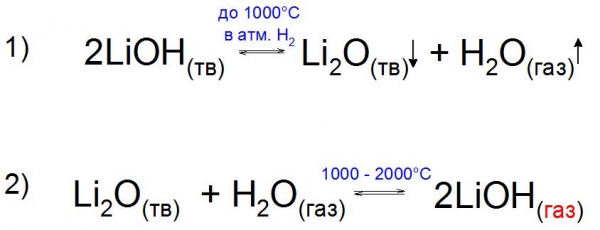
Хімічні властивості
Гідроксид літію кислотою не вважається, оскільки не є амфотерным елементом і не виявляє здатності до розпаду за типом MeOH ↔ MeO- + H+ (де Me – будь-який метал I або II групи основної підгрупи), як і інші представники лужних металів. Про такі з’єднання кажуть, що вони є дуже сильними підставами, так як константа їх дисоціації за принципом MeOH ↔ Me+ + OH – дуже висока (Кb, LiOH = 6,75 · 10-1).
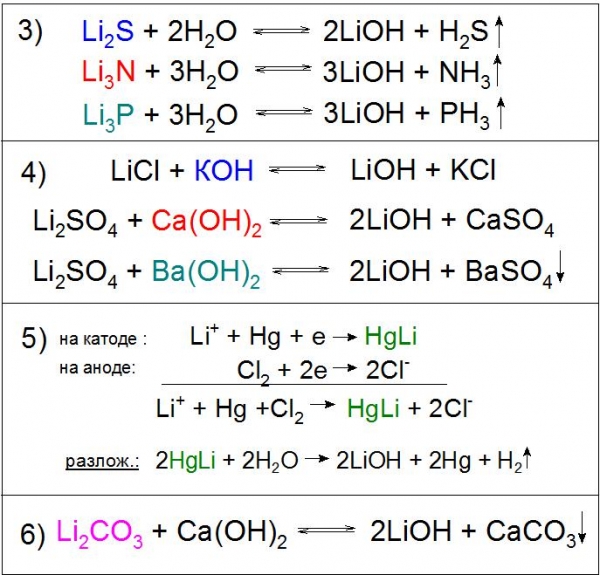
Оскільки подібне з’єднання виявляє сильні основні властивості, що воно може вступати в реакції нейтралізації з кислотами, кислотними оксидами і обміну з різними солями (приклад 3).
Також характерною реакцією є взаємодія холодних і гарячих концентрованих розчинів гідроксиду літію з газоподібним хлором з утворенням гипохлоритов і хлоратів літію (приклад 4).
Особливістю даної підстави є взаємодія з гарячим розчином перекису водню H2O2 з утворенням кристалогідрату перекисного літію Li2O2 в середовищі етанолу, що розділяється в вакуумі (приклад 5).
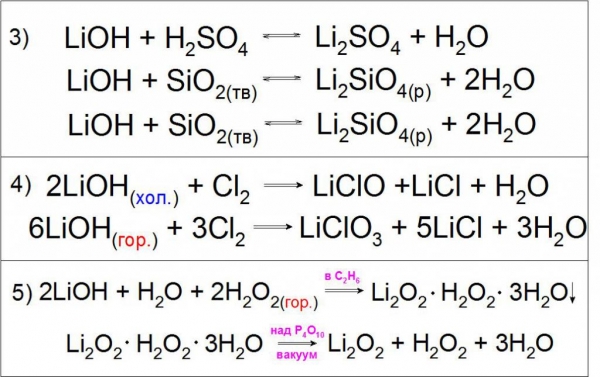
Отримання
LiOH отримують різними способами, одним з яких є безпосередня взаємодія металу або його оксиду з водою за схемою літій → оксид літію → гідроксид літію.

Також застосовується гідроліз сульфіду, нітриду, фосфидов та інших сполук (приклад 3).
Реакції обміну розчинів солей літію можливі практично з будь-якими підставами, наприклад гідроксидом калію (КОН), кальцію (Ca(OH)2) і барію (Ba(OH)2), причому з останнім реагентом хімічна взаємодія йде практично до кінця з сульфатом Li. У першому і другому випадку реакція буде виправдана за рахунок поганої розчинності одержуваних солей в розчині LiOH (приклад 4), а в третьому – до цього додасться нерозчинна у воді BaSO4 (приклад 4). Варто відзначити, що останній варіант не використовується на виробництві з економічних міркувань.
Ще одним примітним методом отримання даної сполуки є електроліз розчину хлориду літію LiCl на ртутному катоді. При цьому утворюється амальгама HgLi, цікава тим, що температура її плавлення значно вища (609 °C), ніж будь-якого його компонента. У процесі розкладання водою отриманого з’єднання утворюється необхідну основу (приклад 5).
Особливе промислове значення має реакція розкладання карбонату літію гашеним вапном, в ході якого хімічна рівновага штучно зсувається праворуч для більш високого виходу основного продукту (приклад 6).
Застосування
Гідроксид літію використовується при отриманні стеарат цього металу для виробництва водотривких морозо – та термостійких мастильних матеріалів. Також застосовується в якості каталізатора при виготовленні полімерних матеріалів і як компонент електроліту в різних акумуляторах.

У пожежної та військовій практиці гідроксид літію використовується як поглинач вуглекислого газу (CO2) в протигазах.