Фтор є самим легким членом сімейства галогенів, елементів групи 17 (VIIA) періодичної таблиці. До цієї групи також належать хлор, бром, йод і астат.
Коротка характеристика
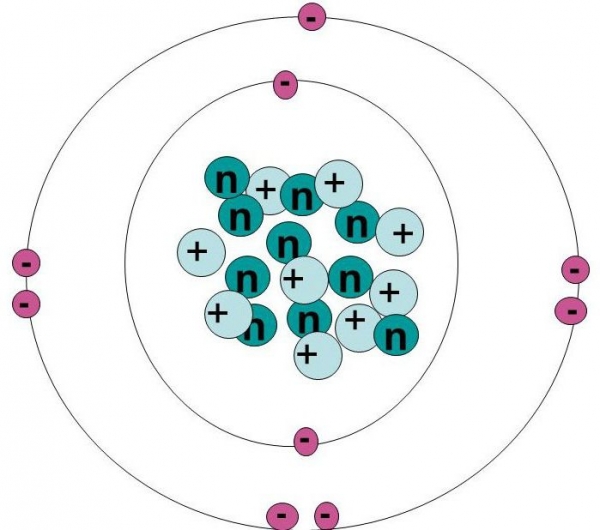
9 електронів фтору утворюють конфігурацію 1s22s22p5. У заповненій внутрішній оболонці знаходяться 2 електрона і 7 – на зовнішній, що залишає 1 вільне місце.
Будова фтору робить його найбільш активним хімічним елементом, який реагує практично з усіма речовинами. При високих температурах і тисках він навіть вступає в реакцію з благородними газами, хоча зазвичай елементи групи 18 (VIIIA), також відомі як інертні гази, не взаємодіють з іншими речовинами.
Фтор був відкритий у 1886 році французьким хіміком Анрі Муассаном (1852-1907). Він зібрав газ, пропускаючи електричний струм через фтористий водень (H2F2).
Про те, що таке фтор, споживачі найбільше знають по двом його сполук. Двоатомний газ використовується для отримання фторидів, з’єднань, які з 1950-х рр. входять до складу зубних паст. Вони ефективні в запобіганні карієсу, тому їх навіть додають в міські системи водопостачання.
Інша група сполук фтору – це хлорфторвуглеці (ХФВ). Протягом багатьох років вони були надзвичайно популярні в якості аерозольних пропеллентов. Однак ХФУ у верхніх шарах атмосфери реагують з озоном (О3). Озоновий шар фільтрує шкідливе ультрафіолетове випромінювання Сонця, яке представляє собою електромагнітну радіацію з довжинами хвиль, меншими довжини фіолетового спектру і, отже, з більш високою енергією, ніж у видимого світла. Тому виробництво ХФВ тепер заборонено.

Історія відкриття
Хімія завжди була небезпечною наукою. А рання хімія була смертельно небезпечним заняттям. Учені працювали з речовинами, про які вони знали дуже мало. Відкриття нових сполук і елементів часто мало трагічні наслідки.
Фтор є надзвичайно небезпечною речовиною. Намагаючись ізолювати елемент, хіміки отримували жахливі опіки і навіть помирали. Газ фтор пошкоджує м’які тканини дихальних шляхів.
На початку 1500-х років німецький вчений Георгій Агрикола (1494-1555) описав плавиковий шпат, який назвав «флюоритом». Це слово походить від латинського дієслова fluere («текти»). Агрікола стверджував, що плавиковий шпат, доданий до розплавленим металевим руд, робив їх більш рідкими, що полегшувало роботу з ними. Німецький учений не знав, що цей мінерал містить фтор у вигляді фториду кальцію (CaF2).
Флюорит став предметом інтенсивного вивчення. У 1670 р. німецький склодув Генріх Шванхард виявив, що суміш плавикового шпату і кислоти утворює речовину, яку можна використовувати для травлення скла, тобто хімічної реакції утворення матової поверхні. Цей процес використовується для нанесення на скло візерунків, а також для створення точних наукових вимірювальних приладів.
У 1771 р. шведським хіміком Карлом Вільгельмом Шеєле (1742-86) було знайдено нове речовина для травлення. Він докладно описав властивості фтористоводневої кислоти (HF). Робота Шеєле сприяла інтенсивному вивченню цього з’єднання.
Хіміки шукали способи розкласти фтористоводневу кислоту на складові. Вони припускали, що повинен бути виявлений елемент, якого вони ніколи не бачили раніше. Проте вони не знали, що таке фтор і яким небезпечним він є. Багато дослідників фтористоводневої кислоти стали інвалідами, вдихнувши газоподібний HF. Один з них, бельгійський хімік Paulin Louyet (1818-1850), помер від впливу цієї речовини.

Нарешті, у 1888 р. проблема була вирішена. Французький хімік Анрі Муассан отримав фтористоводневої розчин (HF) кислоти у фториде калію (KHF2). Потім він охолодив його до -23 °C і пропустив через нього електричний струм. На одному кінці апарату з’явився газ. Новий хімічний елемент отримав назву fluorine, похідне від латинського найменування плавикового шпату. Слово «фтор» в 1810 р. запропонував Андре Ампер. Воно має грецьке походження і означає «руйнування».
Фізичні властивості
Фтор являє собою блідо-жовтий газ з щільністю 1,695 г/л. Це робить його приблизно в 1,3 разів щільніше повітря. Фтор переходить у рідкий стан при температурі -188,13 °C і тверде – при -219,61 °C. Речовина володіє сильним специфічним запахом, схожим на запах хлору і озону, відчутним навіть в дуже малих кількостях – до 20 частин на мільярд. Це властивість дуже корисно для тих, хто працює з фтором – газ можна виявити і уникнути шкідливого впливу при його попаданні в приміщення.
Хімічні властивості
Енергія зв’язку F2 набагато нижче, ніж у Cl2 або Br2 і ідентична перекису водню. Висока электроотрицательность є причиною дисоціації, високої реактивності і сильних хімічних зв’язків фтору з іншими атомами. Він легко вступає в зв’язок з будь-яким іншим елементом, крім гелію, неону і аргону. Фтор реагує з більшістю сполук, часто дуже активно. Наприклад, при змішуванні з водою відбувається вибух. З цих причин в лабораторії необхідно виявляти особливу обережність.
Знаходження в природі
У вільному стані елемент фтор не зустрічається. Найбільш поширеними фторвмісними мінералами є плавиковий шпат, фторапатит і кріоліт. Апатит являє собою складний мінерал, що містить насамперед кальцій, фосфор і кисень, як правило, у поєднанні з фтором. Кріоліт також відомий як гренландський шпат, оскільки острів Гренландія є єдиним комерційним джерелом цього мінералу. В основному він складається з натрийалюминийфторида Na3ALF6.
Головними світовими виробниками сировини для отримання фтору є Китай, Мексика, Монголія і Південна Африка. Сполучені Штати колись добували невелику кількість плавикового шпату, але остання шахта була закрита в 1995 р., і країна стала імпортувати фторовмісні руди.
У земній корі фтор міститься в достатку. Його частка оцінюється приблизно в 0,06%. Це робить його приблизно 13-м найбільш поширеним елементом у земній корі, що приблизно відповідає змісту марганцю або барію.
Що таке фтор-19?
Хімічний елемент має тільки один природний ізотоп – 19F. Ізотопи являють собою іншу форму елемента, що відрізняється по масовому числу, яке відповідає кількості протонів і нейтронів в ядрі атома. Кількість протонів визначає елемент, але число його нейтронів може бути різним. При цьому кожна варіація являє собою ізотоп. У фтору-19 велике гіромагнітне відношення і виняткова чутливість до магнітних полів. Оскільки це єдиний стабільний ізотоп, він використовується в магнітно-резонансної томографії.
Відомі 17 радіоактивних ізотопів фтору. З них найбільш стабільним є 18F. Його ядра діляться з періодом напіврозпаду 109,77 хвилини. 18F іноді використовується для медичних досліджень. Потрапляючи в організм, фтор переміщається в основному в кістки. Його присутність може бути виявлено испускаемым їм випромінюванням. Радіаційна картина дозволяє визначити стан кісткової тканини. Фтор-18 іноді використовується аналогічно вивчення функції мозку.

Отримання, визначення, використання
Промислове виробництво фтору засноване на методі Муассана. Електричний струм напругою 8-12 В пропускають через суміш HF і KF з утворенням H2 і F2.
Визначення фтору в розчинах проводиться методом потенціометрії, тобто вимірювання електродного потенціалу. Мембрана електрода виготовляється з монокристалічного LaF3, легованого дифторидами дорогоцінних металів.
В елементарному стані фтор застосовується відносно мало. Він надто активний для цього. Використовується в ракетному паливі, забезпечуючи горіння, подібно до кисню. Найбільше затребуваний в зв’язаному стані. Фториди являють собою сполуки фтору з металом. Прикладами є фторид натрію (NaF), кальцію (CaF2) і олова (SnF2).
Захист для зубів
Фтор входить до складу зубних паст. Дослідження показали, що невелика кількість фторидів може допомогти знизити захворюваність карієсом. Вони осідають у міру утворення нового матеріалу зуба, що робить його сильним і стійким до руйнування.
У деяких містах фториди додаються в систему водопостачання. Поступаючи таким чином, влада сподівається поліпшити стоматологічне здоров’я городян. Найбільше від цього виграє молодь, чиї зуби все ще розвиваються. Процес додавання фторидів в систему водопостачання називається фторуванням. Занадто великий вміст фтору у воді призводить до потемніння зубів і появі постійних плям.

Користь чи шкода?
Деякі турбуються про довгостроковий вплив фторидів в громадському водопостачанні на здоров’я населення. Вони вказують на те, що фтор є смертельною отрутою, і що його з’єднання також можуть бути токсичними. Це правда, F2 дуже небезпечний, але властивості сполук відрізняються від складових їх елементів. Так що занепокоєння є безпідставною.
Сильний характерний запах фтору дозволяє виявити витік і уникнути контакту з ним.
Фториди, як правило, небезпечні тільки у великих дозах. Їх концентрація у воді зазвичай дуже мала, всього декілька частин на мільйон. Більшість експертів в галузі стоматології та охорони здоров’я вважають, що такий фтор є корисним і не несе загрозу здоров’ю людей.
Тефлон
Випадкові відкриття відіграють велику роль в наукових дослідженнях. Прикладом вдалої і дуже прибутковою випадковості може служити матеріал тефлон – пластик, що виготовляється компанією DuPont Chemical Company. Він став важливим комерційним продуктом, тому що до нього практично майже нічого не прилипає. Сьогодні у кожного є сковороди, внутрішня поверхня яких покрита цим матеріалом, оскільки під час приготування їжа не пригорає. Крім того, тефлонові сковорідки не потребують рослинному або тваринному маслі.

Тефлон був випадково виявлений в 1938 р. хіміком компанії «Дюпон» Роєм Планкеттом (1911-1994), який займався розробкою хлорфторвуглеців (ХФВ). Він хотів дізнатися, що станеться, якщо змішати тетрафторэтилен (ТФЕ) C2F4 з хлорною кислотою. Для проведення експерименту він встановив обладнання таким чином, щоб газоподібний ТФЕ повинен був надходити в ємність з HCl. Але коли він відкрив вентиль, нічого не сталося. Планкетт міг викинути посудину, але він цього не зробив. Замість цього хімік розпиляв його і виявив, що ТФЕ полимеризовался в одну масу, тобто тисячі окремих молекул ТФЕ об’єдналися в одну, звану политетрафторэтиленом (ПТФЕ).
Планкетт вишкребла утворився білий порошок і відправив його вченою «Дюпона», які займалися розробкою штучних волокон. Вони вивчили новий матеріал і виявили його антипригарні властивості. Незабаром для нового матеріалу почалася розробка ряду застосувань.
Компанія DuPont зареєструвала торгову марку Teflon в 1945 р. і через рік випустила свої перші продукти. З тих пір антипригарне покриття стало звичайним на кухонному посуді, тефлон з’явився в спреях для випічки і в якості захисту від плям для тканин і текстилю.
Хлорфторвуглеці
Елемент фтор також використовувався у виробництві фреонів. Хлорфторвуглеці були виявлені в кінці 1920 років американським інженером-хіміком Томасом Мідглі-молодшим (1889-1944). Ці сполуки мають ряд цікавих властивостей. Вони дуже стабільні і не руйнуються при використанні у промисловості. Фреон широко застосовувався в системах кондиціонування і в холодильниках, як чистячих засобів, в аерозолях і в складі спеціалізованих полімерів. Виробництво ХФВ зросла з 1 тис. т у 1935 р. до більш ніж 300 тис. т в 1965 р. і 700 тис. т в 1985 р.
Однак до середини 1980-х рр. дослідження показали, що ці сполуки завдають шкоди озоновому шару, який знаходиться на висоті від 20 до 50 км над поверхнею Землі і важливий для життя на нашій планеті, тому що захищає її від шкідливого ультрафіолетового випромінювання Сонця. Це призвело до поступового припинення виробництва і використання в більшості країн світу. З’явилися нові, безпечні матеріали для Землі, замінили ХФУ.

Захист всього живого
ХФУ раніше були популярними промисловими хімікатами, тому що їх важко зруйнувати. Довгий час ці речовини використовувалися в кондиціонерах і холодильниках як агента, який переносить тепло у зовнішній простір. Але вчені зрозуміли, що ХФУ становлять загрозу для озонового шару, тому що вони руйнуються. Як це можливо? Завжди є ймовірність витоку хладагента з кондиціонерів і холодильників. ХФУ являють собою гази або рідини, які легко випаровуються та піднімаються вгору в атмосферу. В кінцевому підсумку вони досягають озонового шару.
На цій висоті під дією інтенсивного сонячного випромінювання ХФУ руйнуються. Стабільна на землі молекула на великій висоті втрачає ця якість. При її руйнуванні виділяється атом хлору, який може вступати в реакцію з O3. Озон фільтрує шкідливе випромінювання Сонця, що викликає сильні сонячні опіки і рак шкіри. Кисень на це не здатний. Чим більше ХФУ в атмосфері, тим більше атомів хлору. Чим більше атомів хлору, тим менше молекул озону і більше ультрафіолету досягає поверхні Землі, роблячи негативний вплив на здоров’я людини.
До середини 1980 років були отримані докази того, що ХФУ завдають шкоди озоновому шару. Саме це переконало політиків заборонити подальше виробництво і використання хлорфторвуглеців.
Вплив на здоров’я людини
Фтор – хімічний елемент, який може бути дуже небезпечним. При вдиханні невеликих кількостях він викликає сильне роздратування дихальної системи (носа, горла і легенів). У великих кількостях це може призвести до смерті. Найбільша допустима доза фтору становить 1 частина на мільйон частин повітря протягом 8 годин.