Реакції окислення
Бензол досить стійкий до окислювача. Так, він не знебарвлює рожевий розчин перманганату калію. Однак у присутності оксиду ванадію він може окислюватися киснем повітря до малеїнової кислоти:
С6Н6 + 4О —> СООН-СН=СН-СООН.
На повітрі бензол горить з появою кіптяви:
2C6Η6 + 3O2 → 12C + 6Η2O.
Хімічні властивості аренів
- Заміщення.
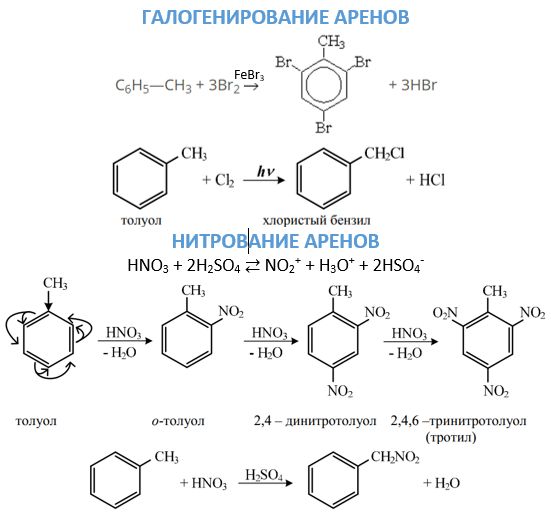
- Галогенирование може йти різними шляхами в залежності від умов проведення реакції. В присутності відповідного галогеніду заліза або алюмінію заміщення буде йти в кільці по механізму, докладно описаному вище. Щоб атом галогену ввести в бічний ланцюг, взаємодія проводять при нагріванні без каталізаторів або на світлі.
- Нітрування ароматичних вуглеводнів іоном нитрония, який утворюється при змішуванні сірчаної та азотної кислоти, що призводить до з’єднання нітрогрупи з бензольным ядром. З’єднання нітрогрупи з бічним ланцюгом можливо при проведенні реакції Коновалова.
 2. Окислення. Дане хімічна властивість аренів можна розглядати з двох точок зору. З одного, вони досить легко окислюються, причому дії піддається бічний ланцюг з утворенням карбоксильної групи. Якщо в молекулі ароматичного вуглеводню з кільцем з’єднані два заступника, то утворюється двухосновная кислота. З іншого боку, вони, як і бензол, горять з утворенням сажі та води.
2. Окислення. Дане хімічна властивість аренів можна розглядати з двох точок зору. З одного, вони досить легко окислюються, причому дії піддається бічний ланцюг з утворенням карбоксильної групи. Якщо в молекулі ароматичного вуглеводню з кільцем з’єднані два заступника, то утворюється двухосновная кислота. З іншого боку, вони, як і бензол, горять з утворенням сажі та води.
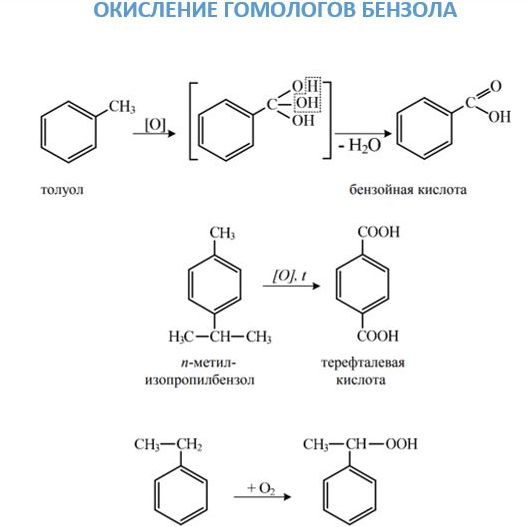

 2. Окислення. Дане хімічна властивість аренів можна розглядати з двох точок зору. З одного, вони досить легко окислюються, причому дії піддається бічний ланцюг з утворенням карбоксильної групи. Якщо в молекулі ароматичного вуглеводню з кільцем з’єднані два заступника, то утворюється двухосновная кислота. З іншого боку, вони, як і бензол, горять з утворенням сажі та води.
2. Окислення. Дане хімічна властивість аренів можна розглядати з двох точок зору. З одного, вони досить легко окислюються, причому дії піддається бічний ланцюг з утворенням карбоксильної групи. Якщо в молекулі ароматичного вуглеводню з кільцем з’єднані два заступника, то утворюється двухосновная кислота. З іншого боку, вони, як і бензол, горять з утворенням сажі та води.










