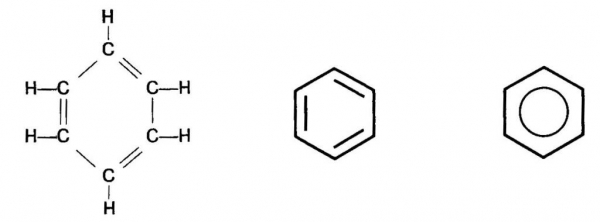
Ароматичні хімічні сполуки, або арени, являють собою велику групу карбоциклических сполук, в молекулах яких міститься стійкий цикл з шести вуглецевих атомів. Вона носить назву «бензольное кільце» й обумовлює особливі фізичні та хімічні властивості аренів.
До ароматичних вуглеводнів відноситься в першу чергу бензол і всілякі його гомологи та похідні.
У молекулах аренів може міститися кілька бензольних кілець. Такі сполуки називають багатоядерними ароматичними сполуками. Наприклад, нафталін – всім відомий препарат для захисту вовняних виробів від молі.
Бензол
Цей найпростіший представник аренів складається тільки з бензольного кільця. Його молекулярна формула С6Н6. Структурну формулу молекули бензолу найчастіше представляють циклічною формою, запропонованої А. Кекуле в 1865 році.
Перевагою цієї формули є правильне відображення складу і рівноцінності всіх атомів З і Н в кільці. Проте вона не могла пояснити багатьох хімічних властивостей аренів, тому твердження про наявність трьох спряжених подвійних зв’язків С=С є помилковим. Це стало відомо лише з появою сучасної теорії зв’язків.
Між тим і сьогодні часто зустрічається написання формули бензолу способом, запропонованим Кекуле. По-перше, з її допомогою зручно записувати рівняння хімічних реакцій. По-друге, сучасні хіміки бачать у ній лише символ, а не реальну структуру. Будова молекули бензолу сьогодні передають різними типами структурних формул.