Особливості реакції вторинних амінів з нитритной кислотою
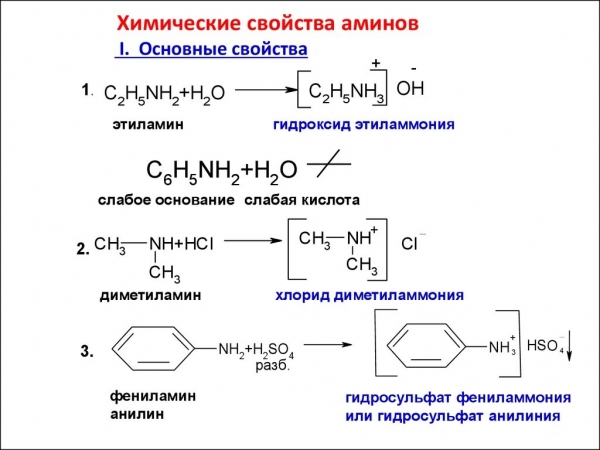
Технологія отримання реактиву HNO2 описана нами вище. Потім до розчину, що містить реактив, додають органічне похідне аміаку, що містить два вуглеводневих радикала, наприклад, діетиламін, молекула якого відповідає загальній формулі вторинних амінів NH2-R-NH2. В продуктах реакції знаходимо нитросоединение: N-нитрозодиэтиламин. Якщо на нього подіяти хлоридною кислотою, то з’єднання розкладається на хлоридну сіль вихідного аміну і хлористий нитрозил. Додамо ще, що третинні аміни не здатні до реакцій з азотистої кислотою. Це пояснюється наступним фактом: нитритная кислота відноситься до слабких кислот, і її солі при взаємодії з амінами, що містять три вуглеводневих радикала, у водних розчинах повністю гідролізуються.
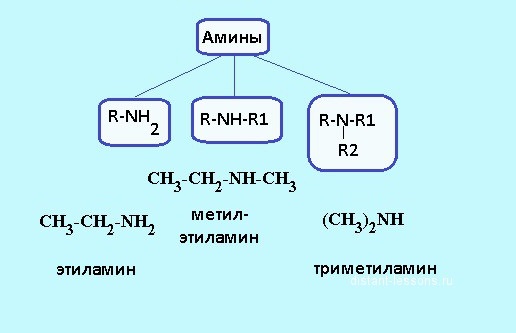
Способи отримання
Аміни, загальна формула яких – R-NH2, можна добути відновленням сполук, що містять азот. Наприклад, це може бути відновлення нитроалканов в присутності каталізатора – металічного нікелю – при нагріванні до +50 ⁰C і при тиску до 100 атм. Нитроэтан, нітропропан або нітрометан в результаті цього процесу перетворюються в аміни. Речовини цього класу можна отримати і відновленням воднем сполук групи нітрилів. Дана реакція проходить в органічних розчинниках, при цьому необхідно присутність нікелевого каталізатора. Якщо в якості відновника використовують металевий натрій, в цьому випадку процес здійснюється в спиртовому розчині. Наведемо в якості прикладів ще два методу: амінування галогеноалканов і спиртів.
У першому випадку утворюється суміш амінів. Амінування спиртів здійснюється наступним способом: суміш парів метанолу або етанолу з аміаком пропускають над окисом кальцію, що виконує роль каталізатора. Утворюються первинні, вторинні і третинні аміни зазвичай можна розділити розгоном.
У нашій статті ми вивчили будову і властивості азотовмісних органічних сполук – амінів.