Этановая кислота більше відома як оцтова. Вона являє собою органічне поєднання з формулою ch 3 cooh. Відноситься до класу карбонових кислот, молекули яких містять функціональні одновалентні карбоксильні групи COOH (або одну, або декілька). Про неї можна представити багато інформації, але зараз увагою варто відзначити лише найцікавіші факти.
Формула
Як вона виглядає, можна зрозуміти по наданим нижче зображенню. Хімічна формула оцтової кислоти нескладна. Це обумовлюється багатьма факторами: саме з’єднання є одноосновным, так і відноситься воно до карбоксильної групи, для якої характерне легке відщеплення протонів (стабільна елементарна частинка). Дане з’єднання – типовий представник карбонових кислот, оскільки воно володіє усіма їх властивостями.
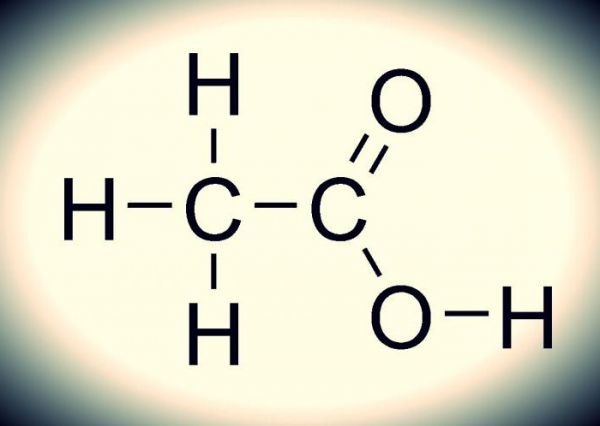
Зв’язок між киснем і воднем (−COOH) – сильнополярная. Це обумовлює легкий процес дисоціації (розчинення, розпаду) даних сполук і прояв їх кислотних властивостей.
В результаті утворюється протон H+ і ацетат-іон CH3COO−. Що представляють собою ці речовини? Ацетат-іон – це ліганд, пов’язаний з певним акцептором (об’єктом, що отримують що-то від донорського з’єднання), утворює стійкі ацетатні комплекси з катіонами багатьох металів. А протон – це, як вже говорилося вище, частка, здатна захоплювати електрон з електронною М-, К – або L – оболонками атома.