Друга група періодичної системи Менделєєва Д. І. містить групу елементів, дуже схожих за своїми властивостями на лужні метали, однак поступаються їм по активності. У неї входять берилій і магній, а також кальцій, стронцій, барій і радій. Вони відомі під загальною назвою – лужноземельні елементи. У нашій статті ми ознайомимося з їх поширенням у природі і застосуванням у промисловості, а також вивчимо найважливіші хімічні властивості лужноземельних металів.

Загальна характеристика
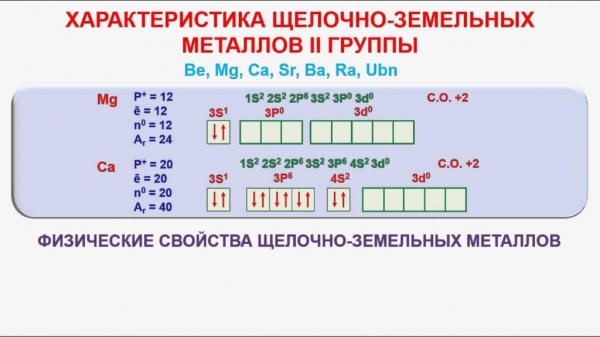
Всі атоми вище перерахованих елементів містять на зовнішньому енергетичному шарі по два електрони. Взаємодіючи з іншими речовинами, вони завжди віддають свої негативні частинки, переходячи в стан катіонів з зарядом 2+. В окисно–відновних реакціях елементи ведуть себе як сильні відновники. По мірі збільшення заряду ядра, хімічні властивості лужноземельних металів та їх активність посилюються. На повітрі вони швидко окислюються, утворюючи на своїй поверхні оксидну плівку. Загальна формула всіх оксидів – RO. Їм відповідають гідроксиди з формулою R(OH)2. Їх основні властивості і розчинність у воді також зростають із збільшенням порядкового номера елемента.
Особливі властивості берилію і магнію
За деякими своїми властивостями перші два представника головної підгрупи другої групи дещо відрізняються від інших лужноземельних елементів. Це проявляються, зокрема, під час взаємодії з водою. Наприклад, хімічні властивості берилію такі, що він взагалі не вступає в реакцію з H2O. Магній ж взаємодіє з водою лише при нагріванні. Зате всі лужноземельні елементи легко реагують з нею при звичайній температурі. Які ж речовини при цьому утворюються?

Підстави лужноземельних металів
Будучи активними елементами, кальцій, барій та інші представники групи швидко витісняють водень з води, в результаті виходять їх гідроксиди. Взаємодія рідкісноземельних металів з водою протікає бурхливо, з виділенням тепла. Розчини підстав кальцію, барію, стронцію мылкие на дотик, при попаданні на шкіру і слизову оболонку очей, викликають сильні опіки. Першою допомогою у таких випадках буде оброблення ранової поверхні слабким розчином оцтової кислоти. Він нейтралізує луг і зменшить ризик виникнення некрозу пошкоджених тканин.
Хімічні властивості лужноземельних металів
Взаємодія з киснем, водою і неметалами – це головний перелік властивостей металів, що входять у другу групу періодичної системи хімічних елементів. Наприклад, кальцій навіть у звичайних умовах вступає в реакції з галогенами: фтором, хлором, бромом і йодом. При нагріванні він з’єднується з сіркою, вуглецем і азотом. Жорстке окислення – горіння, закінчується утворенням оксиду кальцію: 2Ca + O2 = 2 CaO. Взаємодія металів з воднем призводить до появи гідридів. Вони являють собою тугоплавкі речовини білого кольору, мають іонні кристалічні решітки. До важливим хімічним властивостям лужноземельних металів відноситься їх взаємодія з водою. Як вже говорилося раніше, продуктом цієї реакції заміщення буде гідроксид металу. Зазначимо також, що в головній підгрупі другої групи найбільш значуще місце займає кальцій. Тому зупинимося на характеристиці детальніше.
Кальцій і його сполуки
Зміст елемента в земній корі становить до 3,5%, що вказує на його широке поширення у складі таких мінералів, як вапняк, крейда, мармур і кальцит. До складу природного кальцію входить шість видів ізотопів. Він також міститься в джерелах природної води. Сполуки лужних металів детально вивчаються в курсі неорганічної хімії. Наприклад, на уроках у 9 класі учні дізнаються, що кальцій – це легкий, але міцний метал сріблясто-білого кольору. Температура його плавлення і кипіння вище, ніж у лужних елементів. Основний спосіб отримання – електроліз суміші розплавлених солей хлориду і фториду кальцію. До основних хімічними властивостями відносяться його реакції з киснем, водою і неметалами. З сполук лужних металів найбільше значення для промисловості мають оксид та підстава кальцію. Перше з’єднання отримують з крейди або вапна методом випалювання.

Далі з окису кальцію і води утворюється гідроксид кальцію. Суміш його з піском і водою називають будівельним вапняним розчином. Він продовжує застосовуватися в якості штукатурки і для з’єднання цегли при кладці стін. Розчин гідроксиду кальцію, званий вапняною водою, використовують в якості реактиву для виявлення вуглекислого газу. При пропущенні двоокису вуглецю через прозорий водний розчин Ca(OH)2, спостерігається його помутніння внаслідок утворення нерозчинного осаду карбонату кальцію.
Магній та його характеристика
Хімія вивчає властивості лужноземельних металів магнію, акцентуючи увагу на деяких його особливостях. Він являє собою дуже легкий сріблясто-білий метал. Магній, розплавлений в атмосфері з високою вологістю, активно поглинає з водяної пари молекули водню. Остигаючи, метал практично повністю виділяє їх назад у повітря. Він дуже повільно реагує з водою з причини утворення малорастворимого з’єднання – гідроксиду магнію. Луги на магній не діють зовсім. Не метал реагує з деякими кислотами: концентрованої сульфатної і плавикової, внаслідок його пасивації і утворення на поверхні захисної плівки. Більшість мінеральних кислот розчиняють метал, що супроводжується бурхливим виділенням водню. Магній – сильний відновник, він заміщає багато метали з їх оксидів або солей:
BeO + Mg = MgO + Be.
Метал разом з берилієм, марганцем, алюмінієм застосовують як легуючу добавку до сталі. Особливо цінними властивостями володіють магнийсодержащие сплави – електрони. Їх використовують у літакобудуванні і виробництві автомобілів, а також в деталях оптичної техніки.
Роль елементів у життєдіяльності організмів
Наведемо приклади лужноземельних металів, з’єднання яких поширені в живій природі. Магній є центральним атомом в молекулах хлорофілу у рослин. Він бере участь у процесі фотосинтезу та входить до складу активних центрів зеленого пігменту. Атоми магнію фіксують світлову енергію, перетворюючи її потім в енергію хімічних зв’язків органічних сполук: глюкози, амінокислот, гліцерину і жирних кислот. Важливу роль виконує елемент в якості необхідного компонента ферментів, що регулюють обмін речовин в організмі людини. Кальцій – макроелемент, що забезпечує ефективне проходження електричних імпульсів у нервовій тканині. Присутність його фосфорнокислих солей у складі кісток та зубної емалі надає їм твердість і міцність.
Берилій та його властивості
До щелочноземельным металів відносяться також берилій, барій і стронцій. Розглянемо берилій. Елемент мало поширений в природі, в основному, зустрічається у складі мінералів, наприклад, берилу. Його різновиди, що містять різнокольорові домішки, що утворюють дорогоцінні камені: смарагди і аквамарини. Особливістю фізичних властивостей є крихкість і висока твердість. Відмінною рисою атома елемента є наявність на другому зовні енергетичному рівні не вісім, як у всіх інших лужноземельних металів, а тільки двох електронів.

Тому радіус атома і йона непропорційно малий, енергія іонізації велика. Це обумовлює високу міцність кристалічної решітки металу. Хімічні властивості берилію також відрізняють його від інших елементів другої групи. Він реагує не тільки з кислотами, але й з розчинами лугів, витісняючи водень і, утворюючи гидроксобериллаты:
Be + 2NaOH + 2H2O = Na2[Be(OH)4] + H2.
Метал має ряд унікальних характеристик. Завдяки здатності пропускати рентгенівські промені, його застосовують для виготовлення віконець рентгенівських трубок. В ядерній промисловості елемент вважається найкращим сповільнювачем і відбивачем нейтронів. У металургії він застосовується як цінна легирующая добавка, що підвищує антикорозійні властивості сплавів.
Стронцій та барій
Елементи досить поширені в природі і, так само, як лужноземельний метал магній, входять до складу мінералів. Назвемо їх: це барит, целестин, стронцианит. Барій має вид пластичного металу сріблясто-білого кольору. Як і кальцій, представлений кількома ізотопами. На повітрі активно взаємодіє з його компонентів – киснем і азотом, утворюючи оксид і сульфат барію. З цієї причини метал зберігають під шаром парафіну або мінерального масла, уникаючи контакту з повітрям. Обидва металу при нагріванні до 500°C утворюють пероксиди.

З них практичне застосування має перекис барію, використовувана в якості відбілювача тканин. Хімічні властивості лужноземельних металів – барію та стронцію, схожі на властивості кальцію. Проте їх взаємодія з водою протікає значно активніше, а утворилися підстави є більш сильними, ніж гідроксид кальцію. Барій застосовують як добавки до жидкометаллическим теплоносіях, зменшує корозію, в оптиці, при виготовленні вакуумних електронних приладів. Стронцій затребуваний у виробництві фотоелементів і люмінофорів.
Якісні реакції з використанням іонів лужноземельних металів
Сполуки барію та стронцію – це приклади лужноземельних металів, широко використовуваних в піротехніці через яскравого фарбування полум’я їх іонами. Так, сульфат або карбонат стронцію дає карміново-червоне свічення полум’я, а відповідні сполуки барію – жовто-зелене. Для виявлення іонів кальцію в лабораторії на полум’я пальники насипають кілька крупинок хлориду кальцію, полум’я забарвлюється в цегляно-червоний колір.

Розчин хлориду барію застосовують в аналітичній хімії для виявлення в розчині іонів кислотного залишку сульфатної кислоти. Якщо при зливанні розчинів утворюється білий осад сульфату барію – значить, у ньому знаходилися частинки SO42-.
У нашій статті ми вивчили властивості лужноземельних металів та навели приклади їх застосування в різних галузях промисловості.