Поняття вільної енергії Гіббса було введено в хімію з метою пояснення можливості самовільного або спонтанного протікання тієї чи іншої реакції. Розрахунок цієї енергії вимагає знання зміни ентропії процесу та кількості енергії, що поглинається або виділяється при його здійсненні.
Джозайя Віллард Гіббс

Вільна енергія, яка визначає можливість протікання різних процесів, що позначається великою літерою G. Вона дістала назву енергії Гіббса в честь американського фізика-теоретика XIX століття Джозайя Уілларда Гіббса, який вніс найважливіший внесок у розвиток сучасної теорії термодинаміки.
Цікаво відзначити, що перший свій дисертацію, після захисту якої Гіббс отримав звання доктора філософії, він написав про формою зубців шестерень. У цьому дослідженні він використав геометричні методи для розробки ідеальної форми цих зубців. Термодинамікою вчений почав займатися лише у віці 32 років, і в цій області фізики домігся величезних успіхів.
Основні поняття термодинаміки
Стандартної енергією називається енергія Гіббса при стандартних умовах, тобто при кімнатній температурі (25 ºC) і атмосферному тиску (0,1 МПа).
Для розуміння основних принципів термодинаміки слід також ввести поняття ентропії і ентальпії системи.
Під ентальпією слід розуміти внутрішню енергію системи, яка знаходиться при даному тиску і в даному обсязі. Позначається ця величина латинською буквою H і дорівнює U+PV, де U – внутрішня енергія системи, P – тиск, V – об’єм системи.
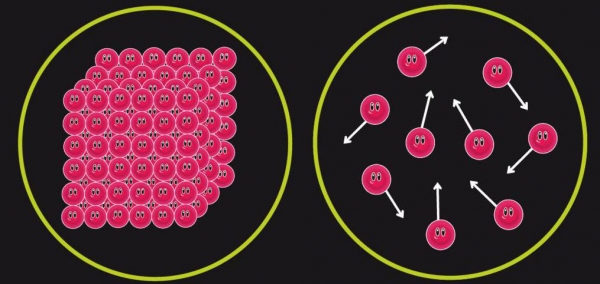
Ентропія системи є фізичною величиною, яка характеризує міру безладдя. Іншими словами, ентропія описує особливість розташування частинок, що складають дану систему, тобто характеризує ймовірність існування кожного стану цієї системи. Позначається вона зазвичай латинською буквою S.
Таким чином, ентальпія є енергетичною характеристикою, а ентропія – геометричної. Зазначимо, що для розуміння і опису протікають термодинамічних процесів, абсолютні значення ентропії і ентальпії не несуть корисної інформації, важливі лише величини їх змін, тобто ΔH і ΔS.
Термодинамічні затвердження
Цей закон допомагає зрозуміти, в якому напрямку може довільно протікати реакція, або ж вона буде перебувати в рівновазі. Наступні твердження є фундаментальними для термодинаміки:
- Другий закон термодинаміки говорить, щоб процес у будь-якій системі відбувався довільно, його ентропія повинна збільшуватися, тобто ΔS>0.
- При постійних температурі і тиску зміна енергії Гіббса системи визначається за формулою ΔG=ΔH−TΔS.
- Якщо для якого-небудь процесу ΔG<0, то він протікає мимовільно і називається экзергоническим.
- Напрямок довільного протікання конкретної реакції може залежати від температури в системі.
Мимовільні процеси
У хімії довільно протікаючими процесами називаються ті, які відбуваються без зовнішнього підведення до них енергії. Довільність протікання говорить про ймовірність такої можливості і ніяк не пов’язано з кінетикою процесу. Так, він може протікати швидко, тобто мати вибуховий характер, але може протікати і дуже повільно протягом тисяч і мільйонів років.

Класичним прикладом мимовільно протікає реакції є перетворення вуглецю у формі алмазу вуглець аллотропной модифікації графіту. Така реакція йде настільки повільно, що за час свого життя людина не помітить будь-яких змін у вихідному алмазі, тому і кажуть, що алмази – вічні, хоча якщо почекати достатній проміжок часу, то можна побачити, як блискучий камінь стає чорним, схожим на сажу графітом.
Виділення і поглинання енергії

Ще одним важливим аспектом довільно протікаючих процесів є виділення або поглинання теплоти, в першому випадку говорять про экзотермическом процесі, у другому випадку – про ендотермічних, тобто мова йде про знакові зміни ентальпії ΔH. Зауважимо, що як екзотермічні, так і ендотермічні процеси можуть протікати довільно.
Яскравим прикладом довільно протікаючого процесу є займання паливної суміші в циліндрі двигуна внутрішнього згоряння. У цій реакції виділяється велика кількість теплової енергії, яка перетворюється з ККД близько 30% в механічну енергію, змушуючи обертатися колінчастий вал. Останній передає крутний момент через трансмісію колесам автомобіля і машина рухається.
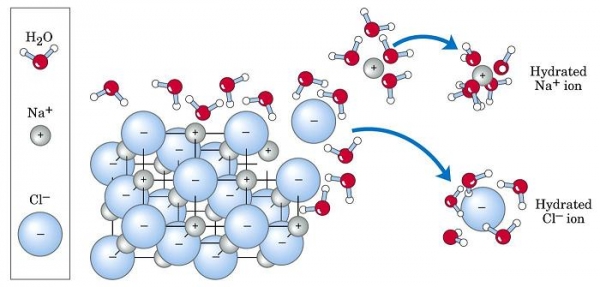
Прикладом ендотермічної реакції, яка протікає самостійно з поглинанням тепла, є розчинення звичайної кухонної солі NaCl у воді. У цій реакції ΔH = +3.87 кДж/моль > 0. Перевірити цей факт можна, вимірявши температуру води до розчинення в ній солі і після її розчинення. Отримана різниця кінцевої і початкової температури виявиться негативною.
Енергія Гіббса процесу
Якщо який-небудь процес протікає в системі з постійним тиском і температурою, тоді другий закон термодинаміки можна переписати в наступному вигляді: G=H−TS. Величина G – вільна енергія Гіббса має розмірність кДж/моль. Визначення спонтанності протікання конкретної реакції залежить від знака зміни цієї величини, тобто ΔG. У підсумку другий закон термодинаміки прийме форму: ΔG=ΔH−TΔS. Можливі такі випадки:
- ΔG<0 – реакція називається экзергонической і довільно відбувається в прямому напрямку з утворенням продуктів;
- ΔG>0 – эндергоническая реакція, яка не може довільно відбуватися в прямому напрямку, але буде самостійно йти у зворотному напрямку зі збільшенням кількості реагентів;
- ΔG=0 – система знаходиться в рівновазі, і концентрації реагентів м продуктів залишаються постійними скільки завгодно тривалий час.
Аналіз отриманого рівняння
Введене вираз для другого закону термодинаміки дозволяє визначити, в якому випадку процес може протікати довільно. Для цього необхідно проаналізувати три величини: зміна ентальпії ΔH, зміна ентропії ΔS і температура T. Зазначимо, що температура виражається в абсолютних одиницях міжнародної системи мір і ваг, тобто в Кельвінах, тому вона завжди є позитивною величиною.
Напрямок протікання реакції не залежить від температури якщо:
- Реакція є екзотермічною (ΔH<0) і її ентропія зростає (ΔS>0). У такому разі процес довільно йде завжди в прямому напрямку;
- Реакція ендотермічний характеру (ΔH>0) і зміна її ентропії негативне (ΔS<0). Процес ніколи не піде спонтанно в прямому напрямку.
Якщо ж знаки зміни величин ΔH і ΔS збігаються, тоді вже температура відіграє важливу роль у можливості протікання такого процесу. Так, екзотермічна реакція буде йти довільно при низьких температурах, а екзотермічна реакція – при високих.
Розрахунок танення льоду

Хорошим прикладом реакції, в якій знак енергії Гіббса залежить від температури, є танення льоду. Для такого процесу ΔH = 6,01 кДж/моль, тобто реакція ендотермічна, ΔS = 22,0 Дж/моль*К, тобто процес відбувається зі збільшенням ентропії.
Обчислимо для танення льоду температуру, при якій зміна енергії Гіббса буде дорівнює нулю, тобто система буде перебувати в рівноважному стані. З другого закону термодинаміки отримуємо: T = ΔH/ΔS, підставляючи значення вказаних величин, обчислюємо T = 6,01/0,022 = 273,18 K.
Якщо перевести температуру з Кельвінів у звичні градуси Цельсія, отримаємо 0 ºC. Тобто при температурі вище цього значення ΔG<0, і танення льоду відбувається мимовільно, при температурі нижче 0 ºC ΔG>0, і довільно вже буде йти зворотний процес, тобто кристалізація рідкої води.