Аномальні властивості води та їх значення для життя
H2O є невід’ємним компонентом існування всього живого. Це пояснює недавній інтерес до виявлення води в інших частинах Всесвіту. Всі відомі біохімічні процеси відбуваються у водному середовищі. Більшість живих істот містять 70-80% H2O по вазі.
Крім того, вода відіграє значну роль в процесі фотосинтезу. Рослини використовують променисту енергію сонця для перетворення води і вуглекислого газу у вуглеводи: 6CO2 + 6H2O + 672 ккал → C6H12O6 + 6O2. Фотосинтез – основна і найважливіша хімічна реакція на Землі. Він постачає поживні речовини, прямо або побічно, всім живим організмам і є основним джерелом атмосферного кисню.
Аномальні властивості води та їх причини
Здатність елементів формувати з’єднання залежить від здатності їх атомів віддавати або приймати електрони. Елементи першого типу стають позитивно зарядженими іонами (катіонами), а другого – негативно зарядженими аніонами.
Здатність елемента взаємодіяти з іншими елементами для утворення сполук називається валентністю. Вона відповідає кількості отриманих або відданих електронів. Для неорганічних сполук алгебраїчна сума валентних чисел елементів дорівнює нулю. Електростатичне тяжіння протилежно заряджених іонів з утворенням сполуки називається іонним зв’язком.
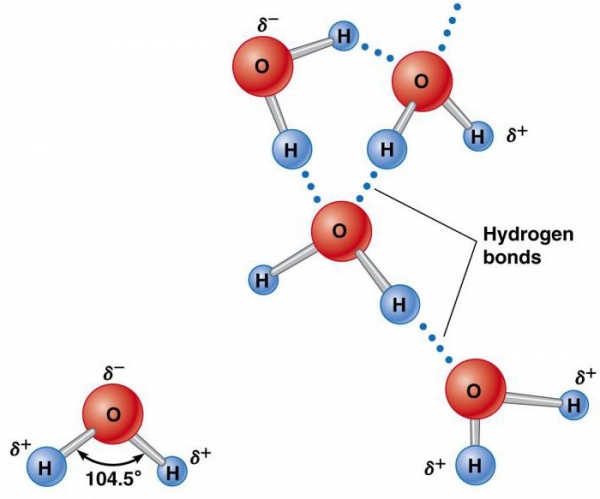
Елементи, які утворюють воду (водень і кисень), існують окремо у молекулах H2 і O2, що містять по два атома. Вони утримуються разом завдяки обміну електронною парою в хімічній зв’язку, званої ковалентного. Вона набагато сильніше іонної. Два атома, утримувані разом ковалентним зв’язком, утворюють набагато більш стійку молекулу, ніж її складові частини. В ній водень об’єднується киснем за допомогою спільних електронних пар. Це унікальне розподіл електронів в утвореному хімічному з’єднанні змушує атоми H розташовуватися по відношенню до O під кутом 104,5°.
Аномальні фізичні властивості води пояснюються її структурою та хімічної зв’язком.
Атом кисню має відносно сильне вплив на загальну пару електронів, у результаті чого атоми водню стають электроположительными, а атом кисню – электроотрицательной областю. Оскільки позитивно і негативно заряджені ділянки розподілені нерівномірно по відношенню до центральної точки, молекула води є полярною.
Така її природа змушує її ставати електростатично привабливою для інших молекул H2O, а також іонів і контактних поверхонь з зарядженими ділянками. Електропозитивні атоми водню притягаються до електронегативний атомів кисню сусідніх молекул води. Це явище називається водневої зв’язком. Її міцність складає всього близько 10% ковалентного, але вона відповідає за більшість аномальних фізичних властивостей води. До них відносяться високі температури замерзання і кипіння, теплоємність, питома теплота плавлення і випаровування, розчинність і поверхневий натяг.
Воднева зв’язок відповідає за підтримку цілісності молекули H2O під час хімічних реакцій. У той час як інші сполуки піддаються іонізації, сама вода зберігає свою хімічну цілісність. Лише відносно невелике число молекул іонізується в водень і гідроксильні іони. Тому H2O є відносно поганим провідником електричного струму. Специфічне опір теоретично чистої води становить 18,3 МОм∙см, в той час як питна має питомий опір менше 10 000 Ом∙див. Таким чином можна легко перевірити чистоту H2O.
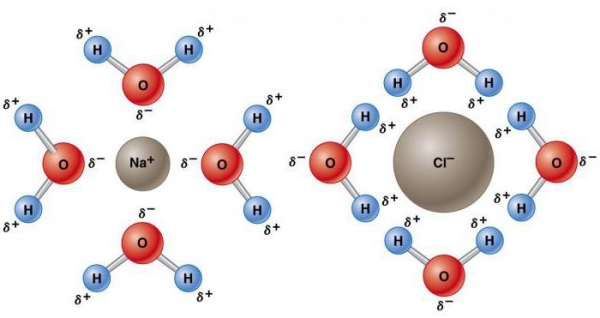
Аномальні властивості води пояснюються наявністю водневих зв’язків, за яких має місце низька щільність льоду. Уздовж них при замерзанні розташовуються молекули, що призводить до розширення речовини. З цієї причини лід плаває на поверхні води. Підвищений тиск знижує температуру плавлення. Тиск, створюваний лезом ковзана, топить лід, створюючи шар, що забезпечує витончене ковзання. Навіть при надзвичайно низьких температурах високий тиск послаблює кристалічну решітку. Це є причиною того, що величезні крижані маси, такі як льодовики, поступово рухаються.