Типи конфігурації
В залежності від положення альфа-вуглецевих атомів щодо пептидного зв’язку остання може мати 2 конфігурації:
- “ціс” (розташовані з однієї сторони);
- “транс” (розташовані з різних сторін).
Транс-форма характеризується більшою стійкістю. Іноді конфігурації характеризують по розташуванню радикалів, що не змінює суті, оскільки вони пов’язані з альфа-вуглецевими атомами.
Явище резонансу
Особливість пептидного зв’язку полягає в тому, що вона на 40% подвійна і може знаходитися в трьох формах:
- Кетольной (0,132 нм) — C-N-зв’язок стабілізована і повністю одинарна.
- Перехідною або мезомерной – проміжна форма, має частково невизначений характер.
- Енольной (0,127 нм) — пептидний зв’язок стає повністю подвійний, а з’єднання З-Про — повністю одинарним. При цьому кисень набуває частково негативний заряд, а атом водню — частково позитивний.
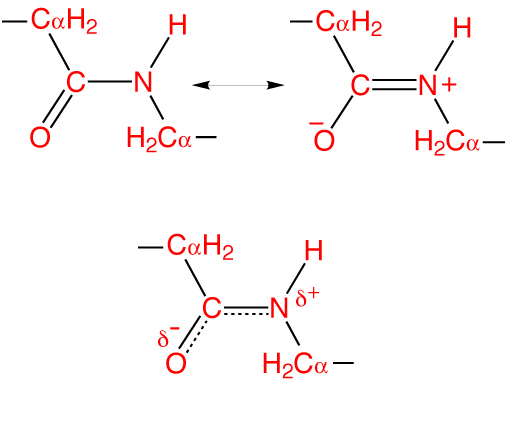
Така особливість називається ефектом резонансу і пояснюється делокализованностью ковалентного зв’язку між атомом вуглецю і азоту. При цьому гібридні sp2-орбіталі формують електронне хмара, що поширюється на атом кисню.