Пептидний зв’язок — це міцне з’єднання між фрагментами двох амінокислот, яке лежить в основі утворення лінійних структур білків і пептидів. В таких молекулах кожна амінокислота (за винятком кінцевих) з’єднується з попередньою та наступною.
В залежності від кількості ланок пептидні зв’язки можуть створювати дипептиды (складаються з двох амінокислот), трипептиды (з трьох), тетрапептиды, пентапептіди і т. д. Короткі ланцюжка (від 10 до 50 мономерів) називають олигопептидами, а довгі — поліпептидами та білками (мовляв. маса більше 10 тис. Та).
Характеристика пептидного зв’язку
Пептидний зв’язок — це ковалентное хімічне з’єднання між першим атомом вуглецю однієї амінокислоти та атомом азоту іншого, що виникає в результаті взаємодії альфа-карбоксильної групи (COOH) з альфа-аміногрупою (NH2). При цьому відбувається нуклеофильное заміщення OH-гідроксилу на аміногрупу, від якої відділяється водень. В результаті утворюється одинарна C-N зв’язок і молекула води.
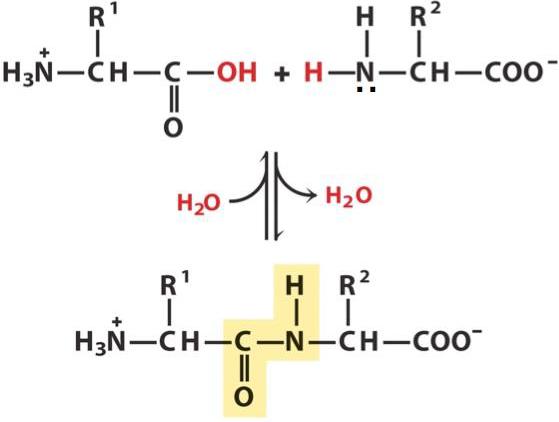
Так як під час реакції відбувається втрата деяких компонентів (ОН-групи і атома водню), ланки пептиду називають вже не амінокислотами, а амінокислотними залишками. З-за того, що останні містять по 2 атома вуглецю, в пептидного ланцюга відбувається чергування С-С та с-N зв’язків, які формують пептидний остов. З боків від нього розташовуються амінокислотні радикали. Відстань між атомами вуглецю й азоту варіює від 0,132 до 0,127 нм, що свідчить про невизначеною зв’язку.
Пептидний зв’язок — це дуже міцний вид хімічної взаємодії. При стандартних біохімічних умовах, відповідних клітинної середовищі, вона не піддається самостійного руйнування.
Для пептидного зв’язку білків і пептидів характерно властивість копланарности, оскільки усі атоми, які беруть участь в її освіті (C, N, O і H), розташовуються в одній площині. Це явище пояснюється жорсткістю (тобто неможливістю обертання елементів навколо зв’язку), що виникає в результаті резонансної стабілізації. В межах амінокислотної ланцюга між площинами пептидних груп знаходяться α-вуглецеві атоми, пов’язані з радикалами.
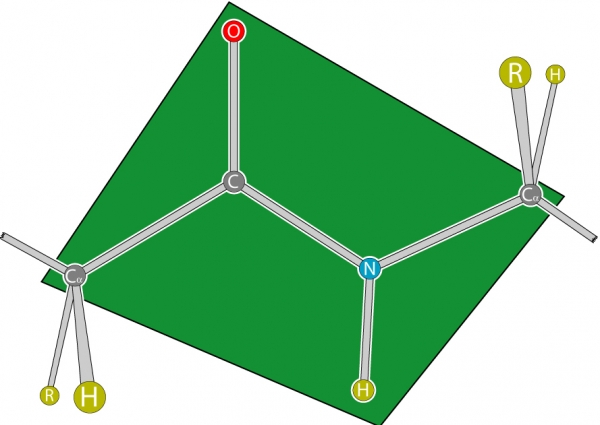
Типи конфігурації
В залежності від положення альфа-вуглецевих атомів щодо пептидного зв’язку остання може мати 2 конфігурації:
- “ціс” (розташовані з однієї сторони);
- “транс” (розташовані з різних сторін).
Транс-форма характеризується більшою стійкістю. Іноді конфігурації характеризують по розташуванню радикалів, що не змінює суті, оскільки вони пов’язані з альфа-вуглецевими атомами.
Явище резонансу
Особливість пептидного зв’язку полягає в тому, що вона на 40% подвійна і може знаходитися в трьох формах:
- Кетольной (0,132 нм) — C-N-зв’язок стабілізована і повністю одинарна.
- Перехідною або мезомерной – проміжна форма, має частково невизначений характер.
- Енольной (0,127 нм) — пептидний зв’язок стає повністю подвійний, а з’єднання З-Про — повністю одинарним. При цьому кисень набуває частково негативний заряд, а атом водню — частково позитивний.
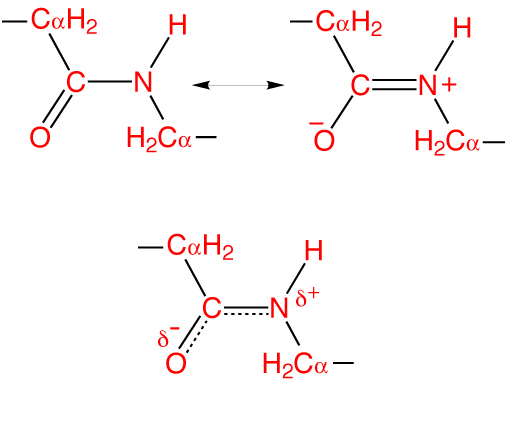
Така особливість називається ефектом резонансу і пояснюється делокализованностью ковалентного зв’язку між атомом вуглецю і азоту. При цьому гібридні sp2-орбіталі формують електронне хмара, що поширюється на атом кисню.
Формування пептидного зв’язку
Формування пептидного зв’язку — це типова реакція поліконденсації, яка термодинамічно невигідним. У природних умовах рівновага зміщується в бік вільних амінокислот, тому для здійснення синтезу потрібен каталізатор, що активує або модифікувальний карбоксильную групу для більш легкого догляду гідроксильної.
У живій клітині утворення пептидного зв’язку відбувається в белоксинтезирующем центрі, де в ролі каталізатора виступають специфічні ферменти, які працюють з витратою енергії макроергічних зв’язків.









