Гідрогенізація і горіння етилену
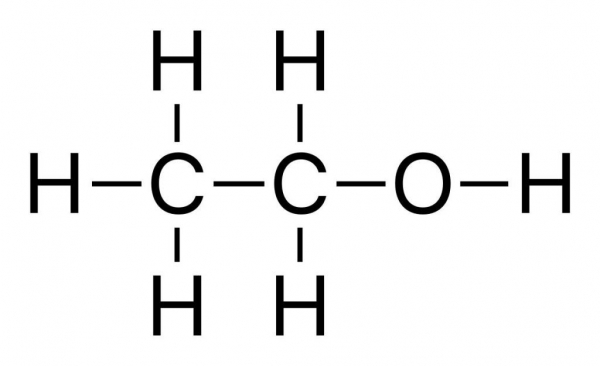
Незважаючи на все вищесказане, реакція з’єднання водню не має великого практичного значення. Проте вона показує генетичний зв’язок між різними класами органічних сполук, у даному випадку алканів і олефінів. Приєднуючи водень, этен перетворюється в етан. Протилежний процес – відщеплення від граничних вуглеводнів атомів водню призводить до утворення представника алкенів – этена. Жорстке окиснення олефінів, зване горінням, супроводжується виділенням великої кількості тепла, реакція є екзотермічною. Продукти згоряння однакові для речовин всіх класів вуглеводнів: алканів, неграничних сполук ряду етилену і ацетилену, ароматичних речовин. До них відносяться вуглекислий газ і вода. Повітря в реакції з етиленом утворює вибухову суміш.

Реакції окислення
Этен може окислюватися розчином перманганату калію. Це одна з якісних реакцій, з допомогою якої доводять наявність подвійного зв’язку у складі визначуваної речовини. Фіолетове забарвлення розчину зникає внаслідок розриву подвійного зв’язку і освіти двоатомних граничного спирту – етиленгліколю. Продукт реакції має широкий спектр застосування в промисловості в якості сировини для отримання синтетичних волокон, наприклад лавсану, вибухових речовин та антифризів. Як бачимо, хімічні властивості етилену використовуються для одержання цінних сполук і матеріалів.