Взаємодія олефінів з елементами головної підгрупи сьомої групи
Всі члени гомологічного ряду этена приєднують атоми галогенів за місцем розриву пі-зв’язку в своїй молекулі. Так, водний розчин брому червоно-коричневого кольору знебарвлюється, у результаті чого утворюється рівняння етилену – дибромэтан:
C2H4 + Br2 = C2H4Br2
Аналогічно протікає реакція з хлором і йодом, в ній приєднання атомів галогенів також відбувається за місцем руйнування подвійний зв’язку. Всі з’єднання – олефіни можуть взаємодіяти з галогеноводородами: хлороводнем, фтороводородом і т. д. В результаті реакції приєднання, що протікає по іонному механізму, утворюється речовини – галогенопроизводные граничних вуглеводнів: хлоретан, фторэтан.
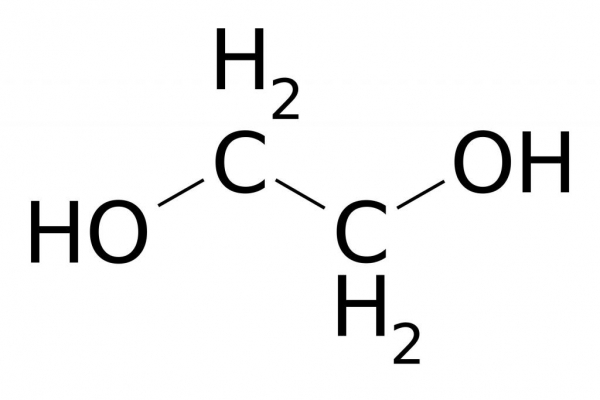
Промислове виробництво етанолу
Хімічні властивості етилену часто використовують для одержання важливих речовин, які широко застосовуються в промисловості та побуті. Наприклад, нагріваючи этен з водою в присутності ортофосфорної або сірчаної кислот, під дією каталізатора відбувається процес гідратації. Він йде з утворенням етилового спирту – багатотоннажного продукту, одержуваного на хімічних підприємствах органічного синтезу. Механізм реакції гідратації протікає по аналогії з іншими реакціями приєднання. Крім того, взаємодія етилену з водою також відбувається в результаті розриву пі-зв’язку. До вільним валентності атомів вуглецю этена приєднуються атоми водню і гидроксогруппа, що входять до складу молекули води.












