Титриметричний метод аналізу (титрування) дозволяє провести об’ємний кількісний аналіз і знаходить широке застосування в хімії. Його головне достоїнство – різноманітність способів і методів, завдяки чому його можна використовувати для вирішення різноманітних аналітичних задач.
Принцип аналізу
Титриметричний метод аналізу заснований на вимірюванні об’єму розчину відомої концентрації (титранта), що вступив у реакцію з досліджуваним речовиною.
Для аналізу знадобиться спеціальне обладнання, а саме, бюретка – тонка скляна трубка з нанесеною градуювання. Верхній кінець цієї трубки відкритий, а на нижньому знаходиться запірний кран. Прокалиброванную бюретку з допомогою воронки заповнюють титрантом до нульової позначки. Аналіз проводять до кінцевої точки титрування (КТТ), додаючи невелику кількість розчину з бюретки до досліджуваного речовини. Кінцеву точку титрування визначають за зміною кольору індикатора або якого-небудь фізико-хімічної властивості.
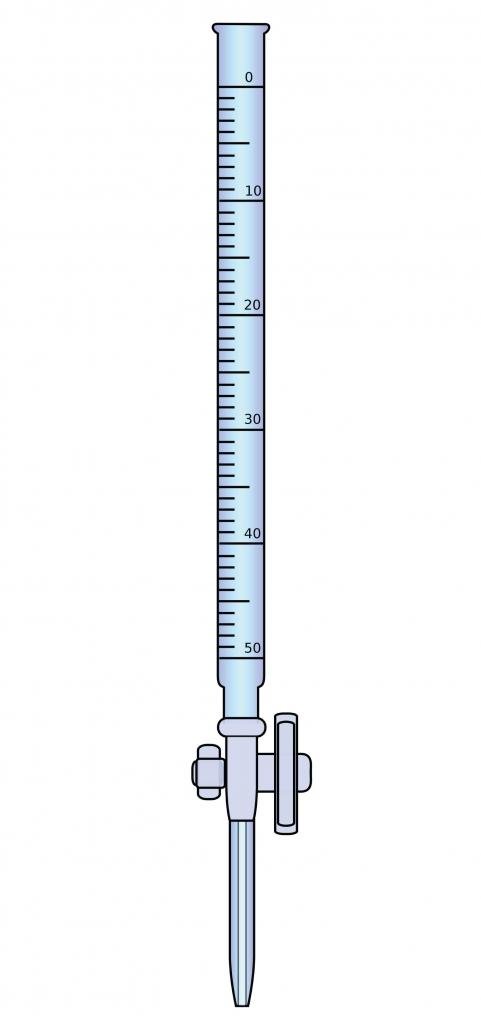
Кінцевий результат розраховується по витраченому об’єму титранта і виражається в титрі (Т) – масі речовини, що припадає на 1 мл розчину (г/мл).