Нітросполуки є незамінними речовинами при синтезі різних азобарвників, а також у виготовленні піротехнічних та вибухових виробів. Зокрема, нітробензол, формула якого наведена нижче, застосовують як основний реагент в більшості подібних виробництв, оскільки особливості його хімічної природи визначили важливість використання цього простого представника нитроаренов.
Структура сполуки
У хімії формула нітробензолу зображується у вигляді ароматичного кільця, до якого приєднана нитрогруппа, що володіє яскраво вираженими электроакцепторными властивостями. Іон нитрония NO2+ позбавляє з’єднання здатності до подальшого электрофильному заміщення. Даний заступник відтягує електронну щільність ароматичного кільця в структурній формулі нітробензолу на себе (приклад 1), тим самим роблячи його мало реакционноспособным до будь-яких подібних реакцій, у тому числі до синтезу по Фриделю-Крафтсу.

Ця особливість виражається і в нездатності легкого полинитрования подібних з’єднань, тому для прямого отримання динитро – і тринитробензолов потрібні досить жорсткі умови і додаткові агенти, наприклад, високі температури або каталізатори. Проте присутність в молекулі будь-яких электродонорных заступників начебто метилової або гидроксигруппы полегшує не тільки реакції приєднання, але і сприяють більш простому нуклеофільного заміщення. Така особливість пояснює все тим же відтягуванням щільності кільця, тільки в даному випадку вона розподіляється між ориентантами згідно силі їх індуктивного і мезомерного ефектів.
Особливості заступника
Оскільки –NO2 є ориентантом 2-ого роду, її дезактивирующее дію на ароматичне кільце приводить до визначення заступників, переважно, в мета-положення. Але при отриманні нітропохідних, наприклад, толуолу або фенолу ,–NO2 стає в орто – або пара-положення, так як дані заступники за рахунок додавання електронної густини (мезомерный ефект) визначають місце нітрогрупи в з’єднанні (приклад 2). Простіше кажучи, наявність ориентантов 1-ого роду регулює постановку –NO2 в хімічній формулі нітробензолу сильніше, ніж наявність груп 2-го роду.
Отримання нітробензолу
Отримання даної речовини в промисловості здійснюється прямим нитрованием бензолу сумішшю сірчаної (H2SO4) та азотної (HNO3) кислот з виходом від 96 до 99% (приклад 3). Рідко в лабораторних умовах формулу нітробензолу синтезують шляхом заміни або зміни вже наявних груп, оскільки вихід в таких реакціях досить низький, а сам процес вимагає особливих умов.
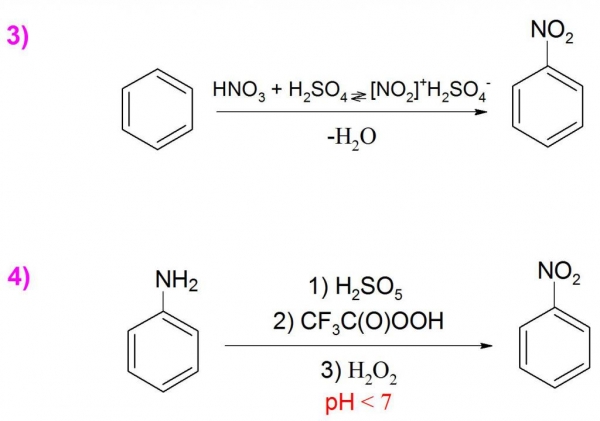
Ще одним спосіб отримання є окислення аніліну пероксисоединениями, наприклад, пероксисерной (H2SO5) або перокситрифторуксусной кислотою (CF3C(O)OOH), а також перекисом водню (H2O2). Ця реакція вимагає контролю показників рН-середовища, так як в лужному середовищі утворюється переважно азоксибензол (приклад 4).
Фізичні властивості
Нітробензол є маслянистою рідиною, нерозчинної у воді, зі специфічним запахом гіркого мигдалю і дуже токсичним для людини. Проте він добре розчинний в органічних розчинниках начебто бензолу та діетилового ефіру. У разі прямого одержання з бензолу, його відокремлюють від непрореагіровавшей суміші перегонкою з водяною парою.
Взаємодія з электрофильными реагентами
Як було сказано вище, наявність нітрогрупи у складі формули нітробензолу робить з’єднання менш реакционноспособным до электрофильному заміщення, однак процес подальшого нітрування все ж може відбуватися під дією сильних кислот та високих температур.

Для отримання динитробензола крім використання нітруючою суміші (H2SO4 + HNO3) потрібно значне термічне вплив, однак процес проходить дуже важко, і в результаті утворюється суміш з великої кількості мета-нітросполуки та неістотних часткою орто – і пара-похідних (приклад 5).
Тринітробензол не утворюється прямим нитрованием, однак при використанні трифтористого бору (BF3) і суміші концентрованих H2SO4 і HNO3 його отримують з досить непоганим виходом (приклад 6).
Нуклеофильное заміщення
За формулою нітробензолу можна судити, що сам по собі він володіє слабкими акцепторними властивостями, тому може працювати тільки з дуже сильними электродонорными речовинами. Найчастіше реагенти діють на нітрогрупу з утворенням азокси – і азосоединений, проте при підборі правильних окислювачів можна отримати невеликий вихід фенольних похідних. Прикладом може служити синтез ізомерів нітрофенолу шляхом прямого впровадження гідроксильної групи в ароматичне кільце (приклад 7). Такі реакції проходять повільно і вимагають дуже жорстких умов.

По мірі збільшення кількості нитрогрупп, такі сполуки проявляють набагато більш сильні акцепторні властивості, що полегшує протікання реакції із слабкими нуклеофільними та основними реагентами.
Роль структури нітробензолу в отриманні первинних амінів
Нитрогруппа є заступником, здатним відновлятися до різноманітних продуктів в кислих, нейтральних та лужних середовищах. Весь процес відновлення структурної формули нітробензолу до первинного аміну можна представити у вигляді багатостадійного процесу.
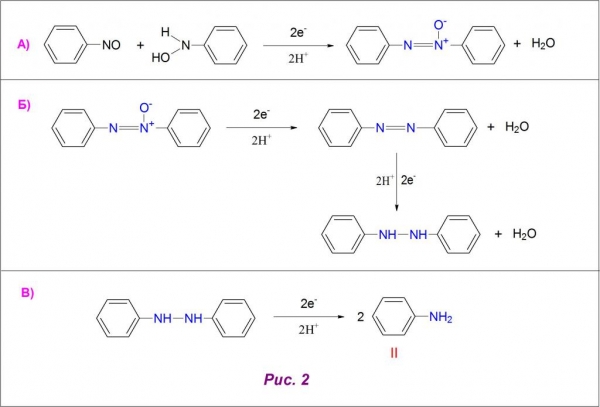
В першу чергу, при приєднанні 2 атомів водню утворюється нитрозобензол, який у чистому вигляді виділити досить важко (рис. 1А).
Наступним етапом відновлення є отримання арилгидроксиламина, який в кислому середовищі (рн < 6) легко перетворюється на анілін (рис. 1Б). Також можливо перебіг побічної перегрупування даного проміжного з’єднання в аминофенолы (рис. 1В). У чистому вигляді арилгидроксиламин отримують при доведенні показників pH-середовища до нейтральних значень.

Лужне середовище (рн > 8) впливає на хід реакції з утворенням азокси і азосоединений як продуктів конденсації арилгидроксиламина і нитрозобензола, останній в даних умовах відновлюється дуже повільно. Одержуваний азоксибензол при підкисленні дає азопроизводное (рис. 2А), а воно, у свою чергу, реагує з атомами водню з утворенням гидразосоединения (рис. 2Б).
При відновленні останнього отримують готовий ариламин (рис. 2В). Структурні формули нітробензолу і аніліну представлені під римськими цифрами I і II на малюнках 1 і 2.
Реакція Зініна
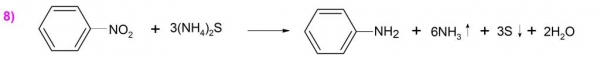
У 1842 р. російський вчений Зінін Н.Н. синтезував з нітробензолу формулу аніліну шляхом відновлення першого сульфідом амонію ((NH4)2S) (приклад 8).
Згодом вчений підтвердив доцільність використання реакції при отриманні ароматичних амінів з інших нітросполук, що дозволило розвинути великомасштабне виробництво синтетичних барвників, вибухових речовин, а також спеціальних фармацевтичних препаратів.












