Будь-який хімічний елемент має різновиди природного або штучного походження, які називаються ізотопами. Відмінність між ними полягає в неоднаковій кількості нейтронів в ядрах і, отже, в атомному вазі, а також у ступені стабільності. Що стосується кількості протонів, то воно однаково, завдяки чому елемент, власне, і залишається самим собою. У цій статті ми звернемося до ізотопів водню – самого легкого і поширений елемент у Всесвіті. Нам належить розглянути їх властивості, роль у природі та область практичного застосування.
Скільки різновидів має водень
Відповідь на це питання залежить від того, які ізотопи водню маються на увазі.
Для цього елемента встановлено три природних ізотопних форми: протій – легкий водень, важкий дейтерій і надважкий тритій. Всі вони виявлені в природному вигляді.
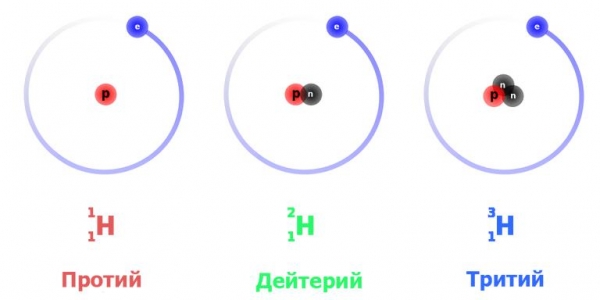
Крім них, існують чотири штучно синтезованих ізотопу: квадий, пентий, гексий і септий. Характеризуються дані різновиди надзвичайною нестабільністю, час життя їх ядер виражається величинами порядку 10-22 – 10-23 секунд.
Таким чином, всього на сьогоднішній день у водню відомо сім ізотопних різновидів. На трьох з них, що мають практичне значення, ми і зосередимо свою увагу.