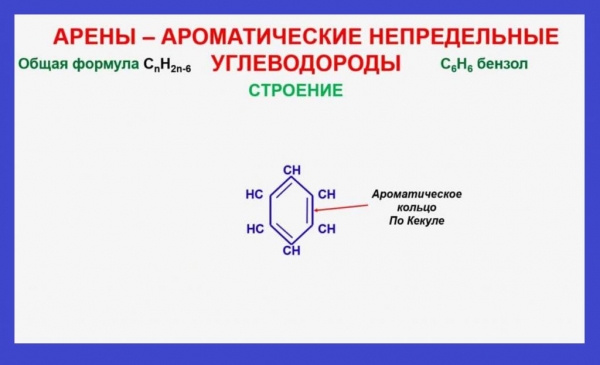
Загадка ароматичного ядра
Перша структурна формула речовини була запропонована німецьким хіміком Кекуле. В ній атоми вуглецю лежать в одній площині і утворюють між собою правильний шестикутник. Частки карбону в молекулі з’єднані двома видами ковалентних зв’язків: одинарними і подвійними.Однак, експерименти не підтвердили наявність в бензолі пі-зв’язків, так як речовина не окислялось розчинами бромної води і перманганату калію. Поясненням цього протиріччя є електронна будова речовини. В його молекулі присутній особливий тип хімічного зв’язку, названий ароматичної або полуторною. Вона представлена загальним електронним хмара, що складається з шести взаємно перекриваються p-електронів. Розташовуючись над і під площиною молекули, зв’язок має вигляд кільця і називається ароматичним ядром. Полуторне зв’язок зумовлює фізичні властивості аренів, а також їх здатність до реакцій заміщення і приєднання.
Механізм процесу заміщення
Система ароматичного ядра має підвищену електронну щільність і може піддаватися атакам електрофільних частинок з дефіцитом негативних зарядів. Підсумком такого впливу буде заміщення атомів водню на інші частинки, наприклад, в молекулі бензолу. Фізичні властивості аренів та особливості перебігу хімічних процесів сильно відрізняються від таких у алканів або алкенів. Більш того, на відміну від інших класів органічних сполук, арени не можна описати однією загальною формулою. Так, для нафталіну формула буде мати наступний вигляд: c n h 2n-12, для бензолу –c n h 2n-6, для дифенила – c n h 2n-14.
Хлорування, бромирование і нітрування ароматичних вуглеводнів відбувається за єдиним механізмом електрофільного заміщення, у якому роль атакувального електрофільного агента грають аніони хлору, брому або нітрогрупи.