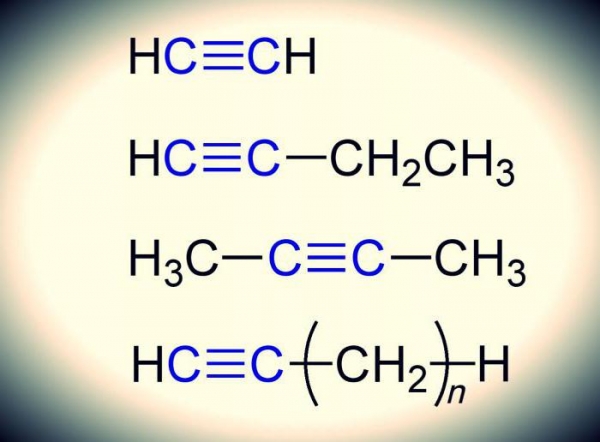
Алкины – це вуглеводні з потрійною ковалентним зв’язком між атомами вуглецю, які утворюють гомологічний ряд, з формулою c n h 2n-2. Самі частинки при таких умовах перебувають у стані sp-гібридизації. Так називається процес змішування різних орбіталей (одноэлектронная хвильова функція) з подальшим виникненням однакових, еквівалентних по своїх характеристиках.
Фізичні властивості алкіной нечисленні, а ось хімічних – цілий ряд. Втім, як одні, так і інші заслуговують уваги.
Схожість з алкенами
Воно дійсно є. Фізичні властивості алкіной схожі на ті, які характерні для алкенів – ациклічних неграничних вуглеводнів подвійний зв’язку. Формула – C N H 2n.
Нижчі алкины – це C2—C4, вони являють собою гази. У них трохи більш високі температури кипіння, ніж у аналогічних алкенів.
Оскільки і ті, і інші сполуки є вуглеводнями, то у воді вони розчиняються погано. Бо їх молекули гідрофобні. В органічних розчинниках, таких як бутанол, ксилол, бензол, сірковуглець, і в багатьох інших розчиняються краще.
Також слід зазначити, що алкени і алкины мають меншу густину, ніж вода. Алкани, насичені вуглеводні з максимально можливим числом атомів водню, теж входять в цей перелік.
Хімічні властивості
Їх дуже багато. І їх теж важливо відзначити увагою, раз мова йде про фізичні і хімічні властивості алкіной. Якщо коротко, то перелік виглядає так:
- Алкины з кінцевими потрійним зв’язком – це С-Н кислоти. Вони з сильними основами утворюють солі, називаються алкинидами.
- Якщо вони вступають у зв’язок з аммиакатами одновалентной міді або срібла, то утворюють якісну реакцію з кінцевими потрійним зв’язком.
- Додавши в алкинид срібла ціанід натрію, можна отримати алкин.
- Алкиниды – сильні нуклеофилы. Вони можуть вступати у різні реакції нуклеофільного заміщення. Що, до речі, нерідко застосовується для синтезу гомологів ацетилену – алкина, фізичні властивості якого будуть розглянуті трохи пізніше.
- Хлоруванням ацетилену хлоридом міді добувають дихлорацетилен. Але тільки у водних розчинах CuCl.
- Якщо впливати на монозамещенние ацетилены галогеном (енергійним окислювачем), то вдасться отримати галогеналкины.
Також дані сполуки можуть брати участь у реакціях карбонилирования, этинилирования, електрофільного, радикального та нуклеофільного приєднання, гидроборирования, окислення, ізомеризації, олігомеризації, полімеризації, циклообразования і т. д.

Етін
Фізичні властивості алкіной найкраще продемонструвати на конкретних прикладах, звернувшись до характеристик представників даної групи сполук.
Етін – це безбарвний газ, також іменований ацетиленом. Формула – С2Н2. У воді, як і будь-який інший алкин, не розчинний. Легше повітря. Закипає при температурі -83,8 °C. Розкладається при стисненні з вибухом. Етін зберігають у балонах, заповнених або просоченим ацетоном активованим вугіллям, або кизельгуром (гірська порода, що складається з решток діатомових водоростей). В таких умовах етін розчиняється у великих кількостях під тиском.
Цей газ не можна випускати на відкрите повітря. Він вибухонебезпечний. Цікаво, що частки даного з’єднання були виявлені на Нептуні і Уран.
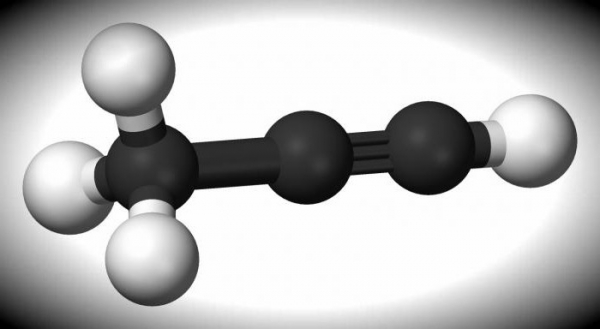
Пропин
Легко займистий безбарвний газ з формулою CH3-C≡CH. Має дуже неприємний різкий запах. Хімічні і фізичні властивості алкина дозволяють використовувати його в якості ракетного палива.
Дана речовина отримують шляхом гідролізу карбіду магнію. Також пропин є побічним продуктом при виробництві ацетилену. Ось ще деякі фізичні і термічні властивості даної речовини:
- Молярна маса – 40.06 до/моль.
- Щільність – 0.70 г/см3.
- Температура плавлення – мінус 102.7°C.
- Температура кипіння – мінус 23.21°C.
- Ентальпія утворення – 185.4 кДж/моль.
Якщо говорити про хімічних властивостях, то варто зазначити, що пропин здатний изомеризоваться в присутності силікатів або інших каталізаторів в аллен – найпростіший представник класу гомокумуленов, ненасичених органічних сполук з кумулированными подвійними зв’язками вуглецю.

Бутин
Перш ніж розповісти про фізичні властивості алкина, відомого під цією назвою, важливо відзначити: йому властива структурна ізомерія. У нього два ізомеру:
- Бутин-1. Температура плавлення – мінус 125.9°C. Закипає при +8.1°C. Щільність – 0.678 г/см3.
- Бутин-2. Температура плавлення – мінус 32.3°C. Закипає при 27°C. Щільність – 0.694 г/см3.
Молярна маса у них однакова – 54,09 г/моль. Але є у бутинах-2 властивість, що не характерно іншим изомеру. Він спалахує. І для цього потрібна температура -49 ℃. При таких умовах пари над поверхнею даної речовини спалахують у повітрі під впливом джерела запалювання. Але стійкого горіння немає.
Пентин
У даного з’єднання також два ізомеру:
- Пентин-1. Формула: СН=-C-CH2-CH2-CH3. Температура плавлення – мінус 90°C. Кипить при +39.3 °C. Щільність дорівнює 0.695 d204.
- Пентин-2. Формула: СН3-С=С-СН2-СН3. Температура плавлення – мінус 101°C. Кипить при +55 °C. Щільність дорівнює 0.714 d204.
В іншому властивості обох ізомерів ідентичні всьому, що було перераховано раніше. У них немає кольору і запаху, вони горять, вступають в реакції приєднання, можуть взаємодіяти з воднем, легше повітря.
До речі, раз мова йде про фізичні властивості алкенів і алкіной, слід зазначити, що є ще таке з’єднання – пентен. Це непредельный вуглеводень з шістьома ізомерами. Пентены – низькокиплячі рідини, які розчиняються лише в органічних розчинниках. Їх температура плавлення знаходиться в діапазоні від -168,5°C та до -137,56°C. Щоб пентен закипів, необхідно від +20,06°C до +38,57°C.

Алкани
Про цих сполуках – наостанок. Розглядаючи фізичні властивості алкіной і алкенів, алкани теж не можна залишити без уваги. Це ациклічні вуглеводні, що мають розгалужене або лінійну будову з простими зв’язками. Формула – C N H 2n+2.
Найпростіший представник цього класу – метан. Безбарвний газ з формулою CH4, нетоксичний і безпечний для здоров’я. Але він стає вибухонебезпечним, якщо накопичується в закритому приміщенні. Особливо коли концентрація знаходиться в проміжку між 4.4% і 17%.
Що стосовно фізичних властивостей? Молярна маса – 16.05 г/моль. Щільність – 0,7168 кг/м3 в газовому стані. Плавиться при -182,49 °C, а закипає при -161,58 °C. Може самозайматися, якщо температура досягне показника в 537,8 °C.