Оцтова кислота, синтетичний каучук, полихлорвинилхлоридные смоли… Що спільного може бути між цими сполуками? Виявляється, їх отримують з одного і того ж вуглеводню – ацетилену, який відноситься до класу алкіной. Властивості та отримання речовин, що мають потрійну зв’язок в молекулі, ми і розглянемо в нашій статті.
Будова молекули этина
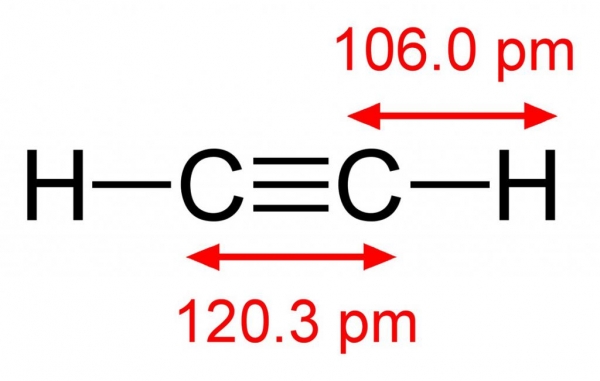
Молекулярна формула C2H2 належить углеводороду, за своїми властивостями є ще більш ненасичених з’єднанням, ніж етилен. Атоми вуглецю в молекулі ацетилену пов’язані між собою однією простий і двома пі-зв’язками. У просторі вони розташовані по-різному. Ненасичені зв’язку взаємно перпендикулярні один одному, а сигма-зв’язок знаходиться безпосередньо в площині молекули. Така будова этина, найпростішого представника ненасичених сполук, що визначає хімічні властивості та отримання алкіной.

Гомологічний ряд та фізична характеристика
Загальна формула класу досліджуваних нами сполук – CH. Вона аналогічна формулі дієнових вуглеводнів, які є для алкіной ізомерами. Назви сполук утворюються від відповідних парафінів заміною суфікса-ан на частинку -ін. Наприклад, бутан – бутин. Перші представники алкіной – гази. Із збільшенням молекулярної маси температура кипіння вуглеводнів підвищується. Так, у ацетилену вона становить -83,8°, а у бутинах вже +8,5°. Ацетилен, як найпростіший алкин, не має запаху, він легше, ніж повітря, і погано розчинний у воді.
Вибухонебезпечні суміші газу з повітрям. Якщо концентрація этина становить від 2,7% до 80%, вони можуть спалахнути від іскри. Алкины легко горять на повітрі (продукти їх жорсткого окислення – вуглекислий газ і вода), процес супроводжується виділенням великої кількості енергії. Сполуки погано розчиняються у воді, проте, застосовуючи невисокий тиск до 15 атм, їх можна розчинити в ацетоні. Так як ацетилен вибухає від ударів і механічних вібрацій, метою дотримання техніки безпеки його зберігають і перевозять у балонах, що містять пористі стінки, просочені розчином ацетону. В атмосфері з дефіцитом кисню речовини згорають коптящим полум’ям, це відбувається за рахунок частинок вуглецю, перетворюються в сажу.
Реакції приєднання
Одна з характерних особливостей алкіной – здатність притягувати до себе атоми різних елементів. Наприклад, гідрогенізація – насичення з’єднання водневими частками, проходить в умовах підвищеної температури і наявності нікелевого каталізатора. Продуктами реакції будуть різні олефіни, а при надлишку концентрації водню – алкани. Наприклад, кінцевим продуктом гідрування ацетилену є етан:
C2H2 +2H2 = C2H6
Ще швидше до ацетилену приєднуються галогени і галогеноводороды. Процес протікає в два етапи. Одна з таких реакцій – взаємодія з бромною водою, використовується в аналітичній хімії для розпізнавання неграничних вуглеводнів. В результаті буре забарвлення розчину брому зникає. Реакції отримання алкіной з відповідних алканів або олефінів є, по суті, протилежними процесів приєднання. Так, отримання этина з етилену можна виразити таким рівнянням:
C2H4 = C2H2 + H2
Алкины окислюються і внаслідок впливу на них розчину перманганату калію, що має фіолетовий колір. Під впливом неграничних зв’язків ненасичених вуглеводнів він знебарвлюється. В продуктах реакції можна виявити двоатомний граничний спирт – етиленгліколь.

Принцип Марковнікова
Приєднання галогеноводнів за принципом Марковнікова до алкинам, отримання галогеносодержащих вуглеводнів знайшло широке застосування в хімії органічного синтезу для видобутку різноманітних видів полімерних речовин – смол.
Розглянемо механізм приєднання на прикладі реакції гомологів ацетилену з хлороводнем, що веде до утворення вінілхлориду або хлористого вінілу. Реакція має важливе промислове значення, так як отриманий продукт служить вихідною сировиною для одержання полімерів – синтетичних смол:
C2H2 + HCl = C2H3Cl – хлористий вініл
Наприклад, приєднання бромоводорода до пропину проходить з урахуванням принципу, відкритого російським хіміком Н. Марковниковым. Суть його полягає в тому, що атом водню, що входить до складу молекули HBr, приєднується до більш гидрогенизированной частці вуглецю при потрійний зв’язку, а галоген – до ненасыщенному воднем атому вуглецю.
Отримання алкінів
Так як ацетилен є вуглеводнем, що мають найбільше практичне значення, розглянемо, яким способом його отримують в лабораторних умовах і на хімічних підприємствах. Карбідний метод є не лише найстарішим, але й досить поширеним способом отримання газоподібного ацетилену. Головний його недолік – висока собівартість продукту з-за великої витрати електроенергії. Гідратація карбіду кальцію є екзотермічним процесом, що призводить до утворення этина:
CaC2 +2 H2O = C2H2 + Ca(OH)2 + Q
Сучасними і більш економічними є способи отримання алкіной з парафінів, що входять до складу природного і попутних нафтових газів, що містять метан. Спрощено цей процес можна записати так:
2CH4 = C2H2 + 3H2
При нагріванні метан розкладається на суміш різних речовин: не тільки вуглець і водень, але і ацетилен. Щоб не допустити розщеплення молекул этина на прості речовини, з’єднання швидко видаляють зі сфери реакції. Існує ще один процес отримання алкіной – виділення їх з компонентів піролізу нафти.
Значення алкіной
Найпростіший представник досліджуваних сполук з потрійним зв’язком в молекулі – це ацетилен. В суміші з киснем він досі застосовується для різання і зварювання металів автогенным способом, температура полум’я при цьому досягає 3150°C. Етін також є основною сировиною для одержання важливих органічних розчинників – трихлорэтана і тетрахлорэтана. Полівінілхлорид, синтезується з хлорвинила, йде на виготовлення пластмасових деталей, що володіють хімічною інертністю і механічною міцністю. Полімер також знайшов застосування для виготовлення штучної шкіри і клейонки. Етін є вихідною сировиною для синтезу оцтової кислоти – найважливішого багатотоннажного органічної речовини.

У нашій статті ми розглянули основні промислові способи одержання і застосування алкіной, а також вивчили особливості будови ненасичених вуглеводнів ряду ацетилену.