У наведеній нижче статті ми визначимо значення поняття «водневий електрод». Не всі знають, що це таке. Тут буде розкрито його загальне значення. Також ми приділимо увагу реакцій окислення і відновлення, які пов’язані з видом експлуатації подібного предмета, і окремо поговоримо про запчастини, які його утворюють.
Введення
Стандартним водневим електродом називають електроди порівняння. Їх використовують в ході вимірювань електрохімічної природи. Також вони знаходять своє застосування у складі гальванічних елементів. Водневий електрод (ВЕ) – це металева пластинка або дріт, яка добре поглинає водень в газоподібному вигляді. Сама пластина занурюється у водні розчини, насичені киснем і містять у собі його іони.

Цей елемент володіє потенціалом, який обумовлюється концентрацією іонів H+ у товщі розчину. Електрод використовують як еталон, за яким визначають потенціал досліджуваних хімічних реакцій. Якщо тиск водню дорівнює одній одиниці атм., а концентрація протонів відповідає співвідношенню 1 моль/л, то потенціал ВЕ вважають рівним нулю. Якщо використовувати в якості поверхні для певної реакції платину, а також ВЕ і визначається електрод, то можна спостерігати цікаву реакцію, в ході якої утворюється стабільний атом водню:
2H++2e-=H2.
Іншими словами, відбувається відновлення або окислення атомів H. Тип реакції обумовлюється потенціал водневого електрода, на якому протікає реакція.
Проводячи вимірювання ЕРС гальванічних засобів з використанням стандартних умов (розчин, про який ми говорили вище), завжди використовують поняття стандартного потенціалу електрода. Він визначається типом хімічної реакції.
Окислення і відновлення
Говорячи про водневих електродах, ми згадали поняття реакції окислення і відновлення, які можуть відбуватися з атомами водню при використанні відповідних електродів.
Відновленням в хімії називають явище, в ході якого:
- Атомарна, іонна частка або молекула приймає (кожна) з одного і більше електронів.
- Спостерігається зниження ступеня окислення певних атомів у певній частці.
- Речовини органічної природи втрачають кисневі атоми та/або набувають водневі.
Раніше відновленням вважалося тільки третє визначення (з середини ХІХ століття), в той час як перше і друге почали застосовуватися лише у 20-х роках минулого століття. На сьогоднішній день вважається, що друге визначення можна вважати спільним для всіх відновлювальних процесів у хімії. За допомогою третього виду опису, найчастіше виділяють і розпізнають реакції окисно-відновного характеру.

Розглянемо детальніше. Під окисленням мають на увазі процес, який супроводжується поступовим збільшенням атомної ступеня окислення певної речовини. Це відбувається за допомогою «транспортування» електронів від атома-донора, що відповідає за віддачу e-, до акцепторної атому, який буде приймати e-.
Введення терміна в науковий і повсякденний обіг мовних одиниць зобов’язана академіку В. М. Севергину. Це нововведення було скоєно на рубежі між XVII і XIX століттям. Вчений позначав цим терміном процеси взаємодії кисню (який міститься в повітрі) з іншими речовинами. Іноді реакції окислення можуть призводити до утворення нестабільних частинок та їх подальшого розпаду на більш дрібні складові компоненти реакції.
Застосування
Водневі електроди найчастіше використовують для проведення робіт з вимірювання стандартного потенціалу електрохімічного характеру. Також застосовують з метою визначення рівня концентрації іонів водню і будь-яких інших видів іонів. Ще з використанням ВЕ проводять дослідження, які допомагають дізнатися добуток розчинності по відношенню до конкретизированному константу швидкості в ході деяких електрохімічних реакцій.
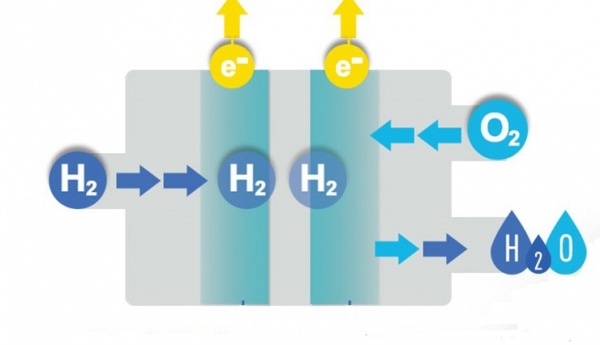
Найважливішими вимогами до електрода порівняння вважаються:
- Здатність працювати в температурних інтервалах.
- Стабільність робочого процесу.
- Здатність відтворювати результат реакції і дослідження.
- Сумісність з досліджуваним розплавом.
- Відсутність стаціонарного потенціалу.
Механізм пристрою
Пристрій стандартних водневих електродів включає в себе:
- Електрод з платини – елемент системи, який має здатність виключати забруднення розчину стороннім поруч іонів в ході протікання електролізу. Подібні деталі не мають чистими ділянками поверхні (за винятком порівняно вузькі райони потенціалів). Область реагування речовин називають двойнослойной. Вона характеризується тим, що тут стикаються тільки метал, іони і розчинник. Причому останній перебуває в особливому стані. В залежності від значення потенціалу, метал може покриватися воднем абсорбувати вигляді (низьке значення) або оксидами (високе значення).
- Електролітичний місток – засіб для сполучення двох половин гальванічної структури механізму.
- Підводиться речовина газоподібного водню.
- Розчини кислоти (частіше HCl) з концентрацією катіонів водню H+=1 моль/літр.
- Перешкоджає проникненню молекул кисню (повітря) затвор.

Потенціал
Обчислити потенціал водневого електрода щодо застосування до окремого електроду є неможливим. Однак подібне твердження справедливе тільки для експериментальних шляхів.
Потенціометричні кошти, які відіграють важливу роль у питанні про потенціал електрода, ґрунтуються на визначенні електрорушійної сили (ЕРС):
E=E1–E2;
Де E – це обумовлене ЕРС, а E1 і Е2 виступають в ролі потенціалу електродів ланцюга, яку досліджують.
Як вирахувати? Потенціал водневого електрода дорівнює числу, яке можна визначати за допомогою рівняння Нернста:
E=E0+RT/Nf in aox /анг. ared=E0+RT/nF in[ox]yox/[red]yred
Де:
- E0 – стандартне значення потенціалу редокс-системи;
- R – постійна газу, рівна 8.312 Дж/(моль);
- T – значення абсолютної температури;
- F – постійна Фарадея (96485Кл/моль);
- n – кількість електронів, які є учасниками реакції;
- aox і анг. ared– показники активності різних форм редокс-системи (відповідно окислення і відновлення);
- [ox] і [red] – молярна концентрація речовин, що відповідають за явище окислення або відновлення;
- Гамма [ox] і [red] – величина коефіцієнта активності.

Історичні дані
ВЕ характеризується складністю процесу експлуатації. Однак став відомим і почав застосовуватися досить давно.
ВЕ були власної конструкцією С. П. Л. Серенсена. Він використав їх у якості центрального інструмента для своїх досліджень, які дозволили з’явитися сучасної теорії pH-матерії.
Дж. Ф. Макклендон використовував ВЕ в ряді перших досвідів по дослідженню pH-метрії всередині шлунка. Як це відбувалося? Вчений використовував електрод порівняння, в який містився водневий електрод. Останній вводився разом з pH-зондом всередину шлунка людини.