Диеновый синтез
Реакція Дільса-Адлера дозволила отримувати циклосоединения за досить простим механізмам, не вдаючись до складним багатостадійним реакцій. Суть реакції зводиться до взаємодії спряженого дієна і диенофила, який може бути представлений алкенами і алкинами з электроакцепторными заступниками, а також сполуками, що містять подвійні зв’язки з гетероатомом, наприклад –C=O ‒C=N та ін В результаті утворюється циклічний вуглеводень, тому цю реакцію ще називають «циклоприсоединением».
Синтез за Дільс-Адлєру може проходити в присутності кислот Льюїса, які значно прискорюють перебіг реакції та найчастіше сприяють хорошому виходу основного продукту, а також впливає на утворення енантіомерів і цис-/транс – ізомерії.
Прикладом такої реакції без каталізатора може служити приєднання бутадієну–1,3 до пара-бензохинону в середовищі бензолу при температурі 35 °С, в результаті якого вихід продукту досягає 100%. Синтез проходить з переходом протонів водню між вуглецевими атомами для утворення другого циклу і створення міцного з’єднання. Наприкінці реакції утворюється похідне 1,4–нафтохінона, який може далі реагувати з бутадієном‒1,3 при 100 °с З утворенням циклу на протилежній стороні. З кінцевого продукту реакції шляхом дегідрування можна отримати антрахинон, похідні якого використовуються в якості барвників, наприклад алізарин.
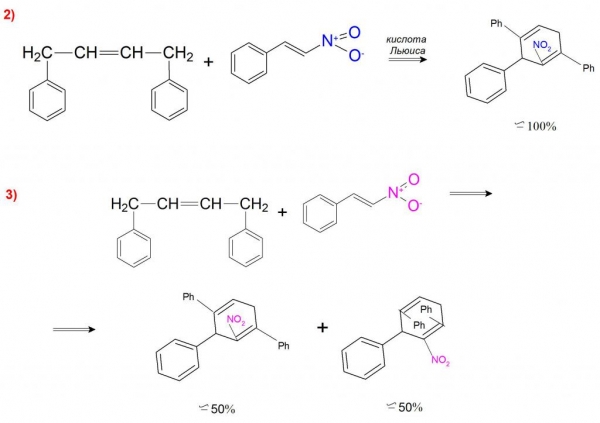
А прикладом каталітичного синтезу може бути реакція 1,4–дифенилбутадиена з β-нитростиролом, де в присутності кислоти Льюїса утворюється тільки ендо-нитроаддукт (приклад 2). Без участі каталізатора ця реакція проходить з утворенням ендо-нітросполуки та ендо-дифениловых продуктів у співвідношенні 1:1 (приклад 3).
Такі реакції підтверджують доцільність використання каталітично активних речовин в диеновом синтезі, так як вони істотно прискорюють процес і значно впливають на регіо- (орто-, пара – і мета-положення) та стереоселективність (оптичні і ендо-/екзо-положення заступників).












