Реакція Лебедєва Сергія Васильовича стала відправною точкою в дослідженнях способів отримання дієнових неграничних вуглеводнів, які добре застосовуються до цих пір при створенні синтетичних каучуків. Це відкриття дозволило використовувати відносно дешевий та рентабельний метод синтезу штучної гуми для військового та технічного призначення, що забезпечило в радянські часи випуск якісної і міцною заміни натуральних каучуків.

Принцип реакції
За принципом протікання даний синтез відносять до каталітичного піролізу (термічного розкладання), який проходить в присутності алюмо-цинкових оксидних каталізаторів при температурі близько 450 °С.
У хімії реакція Лебедєва примітна тим, що вона проходить в одну стадію, але при цьому всередині неї відбувається відразу три зміни:
- відщеплюється вода;
- відривається водень;
- відбувається приєднання між алкільних залишками.
Синтез неодноразово удосконалювався, застосовувалися нові алюмінієві каталізатори з додаванням солей марганцю та інших металів, а також варіювалися умови проведення, що дозволило знизити енергозатратність при підтримці температури (360-370 °С) і збільшити ступінь перетворення спирту в ході реакції (до 50%, вихід бутадієну–1,3 становить 42%).

Реагенти і продукти
У ранніх дослідженнях С. В. Лебедєв вдавався до створення бутадієну з нафтових фракцій. Однак згодом він став отримувати даний дієн етилового спирту, отриманого шляхом бродіння картоплі. Для отримання однієї лише автомобільної шини потрібно переробити до 500 кг картоплі, що, природно, було економічно невигідно.
Пізніше, в період 1926-928 рр., С. В. Лебедєв разом зі своєю командою з учнів і вільних слухачів удосконалив спосіб отримання бутадієну з етилового спирту. Вихід дієна на момент демонстрації результатів був 22%. Завдяки старанням, вчені здобули перемогу на конкурсі, організованому В. В. Сталіним серед зараз вже колишніх країн Радянського Союзу, за пропозиціями способів виробництва синтетичного каучуку.
Так, тепер в кінцевому варіанті синтезу, в основних продуктах отримують бутадієн‒1,3 CH2=CH‒CH=CH2, воду H2O і вільний водень H2. Додатково можуть утворитися деякі ароматичні сполуки, етилен, пропілен, бутилен, вищі спирти і ацетальдегід, але в основному рівнянні реакції Лебедєва формули цих речовин не зазначаються. Оскільки цей дієн є газоподібною речовиною, нерозчинним у воді, його від усіх інших вуглеводнів відокремлюють конденсацією, адсорбцією спиртом, відмиванням H2O або ж ректифікацією.
Механізм реакції
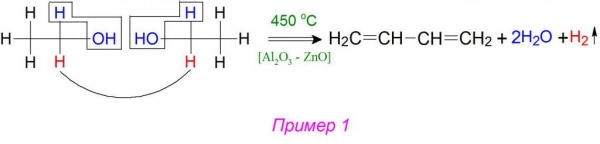
У синтезі при розщепленні (розкладанні) 2 молекули етилового спирту, завдяки дегидратирующе-дегидрирующим каталізаторів, від них відриваються 2 молекули води і 1 молекула газоподібного водню. Згідно з механізмом реакції Лебедєва, алкільні залишки приєднуються один до одного, утворюючи дві неграничні пов’язані подвійні зв’язки в 1,3–положеннях (приклад 1).
Використання в промисловості
Після тріумфальної перемоги на міжнародному конкурсі вченому дали можливість здійснити виробництво синтетичного каучуку в промисловому масштабі. Так як отримання бутадієну з реакції Лебедєва було визнано дуже цінним, його профінансували, і в 1930 році в Ленінграді був побудований дослідний завод “Літер «Б»”, який аж до 1990 року займав перше місце в світі по виробництву штучного каучуку. На базі цього підприємства згодом був створений Всесоюзний науково-дослідний інститут синтетичного каучуку, який продовжує займатися вивченням полімерних сполук.

Подальше вивчення
Відкриття С. В. Лебедєва послужили початком вивчення властивостей дієнових вуглеводнів, завдяки яким був відкритий так званий «диеновый синтез». Існують три версії, за яким він у ході наукової діяльності вивчив реакцію дімерізаціі дієнів. Перша передбачає, що в результаті синтезу вчений отримав димер циклопентадієну. Друга версія говорить про дімерізаціі ізопрену з отриманням дипентена. А третя описує отримання винилциклогексена з двох молекул бутадієну‒1,3. У всякому разі цей синтез ліг в основу подальшого вивчення властивостей спряжених дієнів, які розвивали Отто Дильс і Курт Адлер, удостоєні Нобелівської премії в 1950 році.
Диеновый синтез
Реакція Дільса-Адлера дозволила отримувати циклосоединения за досить простим механізмам, не вдаючись до складним багатостадійним реакцій. Суть реакції зводиться до взаємодії спряженого дієна і диенофила, який може бути представлений алкенами і алкинами з электроакцепторными заступниками, а також сполуками, що містять подвійні зв’язки з гетероатомом, наприклад –C=O ‒C=N та ін В результаті утворюється циклічний вуглеводень, тому цю реакцію ще називають «циклоприсоединением».
Синтез за Дільс-Адлєру може проходити в присутності кислот Льюїса, які значно прискорюють перебіг реакції та найчастіше сприяють хорошому виходу основного продукту, а також впливає на утворення енантіомерів і цис-/транс – ізомерії.
Прикладом такої реакції без каталізатора може служити приєднання бутадієну–1,3 до пара-бензохинону в середовищі бензолу при температурі 35 °С, в результаті якого вихід продукту досягає 100%. Синтез проходить з переходом протонів водню між вуглецевими атомами для утворення другого циклу і створення міцного з’єднання. Наприкінці реакції утворюється похідне 1,4–нафтохінона, який може далі реагувати з бутадієном‒1,3 при 100 °с З утворенням циклу на протилежній стороні. З кінцевого продукту реакції шляхом дегідрування можна отримати антрахинон, похідні якого використовуються в якості барвників, наприклад алізарин.
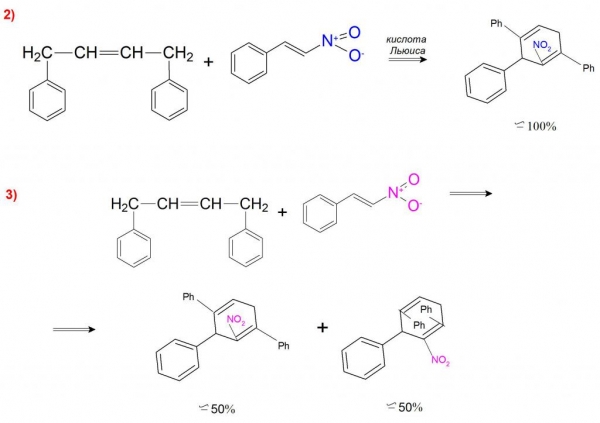
А прикладом каталітичного синтезу може бути реакція 1,4–дифенилбутадиена з β-нитростиролом, де в присутності кислоти Льюїса утворюється тільки ендо-нитроаддукт (приклад 2). Без участі каталізатора ця реакція проходить з утворенням ендо-нітросполуки та ендо-дифениловых продуктів у співвідношенні 1:1 (приклад 3).
Такі реакції підтверджують доцільність використання каталітично активних речовин в диеновом синтезі, так як вони істотно прискорюють процес і значно впливають на регіо- (орто-, пара – і мета-положення) та стереоселективність (оптичні і ендо-/екзо-положення заступників).