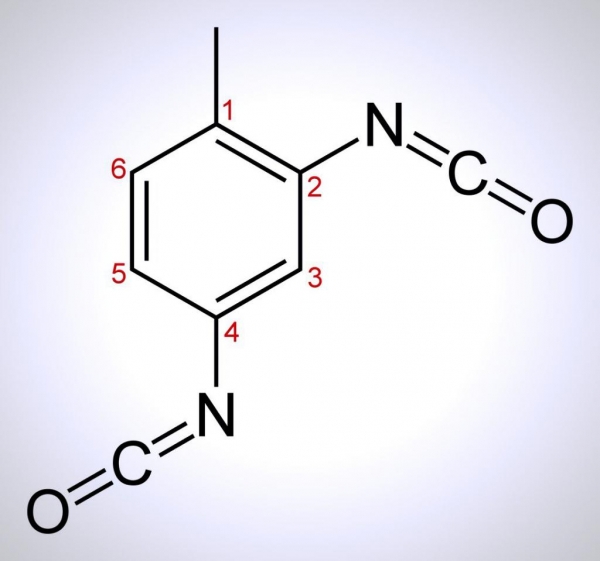
Толуол – це метилбензол, що представляє собою безбарвну рідину, що відноситься до класу аренів, які є органічними сполуками з ароматичною системою в складі.
Ключовою особливістю даного речовини можна вважати його специфічний запах. Втім, це не єдина «відмітна риса» речовини. Властивостей і характеристик у толуолу багато, і про них варто коротко розповісти.

Трохи історії
Хімічні властивості толуолу почали вивчати трохи менше 200 років тому, коли його і отримали вперше. Речовина виявив у 1835 році французький фармацевт і хімік П’єр Жозеф Пеллетьє. Вчений отримав толуол при перегонці соснової смоли.
А через три роки французький физикохимик Анрі Сент-Клер Девіль виділив цю речовину з бальзаму, який він привіз з колумбійського міста Толу. В честь цього напою, власне кажучи, з’єднання і отримало свою назву.
Загальні відомості
Що можна сказати про характеристики і хімічних властивостях толуолу? Речовина являє собою летючу рухливу рідину з різким запахом. Чинить легку наркотичну дію. Реагує з необмеженою кількістю вуглеводнів, взаємодіє з простими і складними ефірами, зі спиртами. З водою не змішується.
Характеристики наступні:
- Речовина позначається формулою С7Н8.
- Його молярна маса дорівнює 92,14 г/моль.
- Щільність становить 0,86694 г/см3.
- Температури плавлення і кипіння рівні -95 ℃ і 110,6 ℃ відповідно.
- Питома теплота випаровування становить 364 кДж/кг.
- Критична температура фазового переходу дорівнює 320 °C.
Ще це речовина відрізняється горючістю. Згорає коптящим полум’ям.