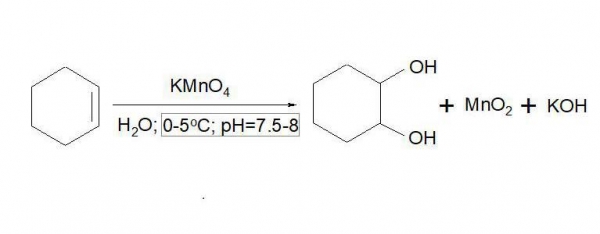
Незважаючи на свою назву, вперше реакція Вагнера з алкенами була проведена ще Марковниковым в 1878 році. Він отримав спирт – циклогександиол-1,2 – з циклогексена, діючи на нього перманганатом калію у водному розчині при 0 oC. Пізніше цей метод отримання двоатомних спиртів розвинув і вивчив інший російський вчений – Вагнер. Датою відкриття реакції вважається 1888 рік, коли була опублікована його монографія “До реакції окислення ненасичених вуглецевих сполук”. Слід згадати, що Вагнер проводив досліди не тільки в нейтральному водному, але також кислому і лужному середовищах.
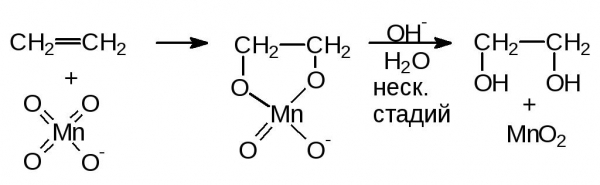
Механізм
Суть реакції полягає в сін-гидроксилировании (одночасному приєднання двох гідроксильних груп) подвійного зв’язку алкена. Реагентом є перманганат калію – сильний окислювач, тому, щоб уникнути подальшого перетворення гідроксильної групи в карбоксильную, необхідно суворо дотримуватися кислотність: оптимальне значення pH – 8, тобто середовище повинна мати слабку лужну реакцію.
Реакція Вагнера проходить через стадію утворення циклічного ефіру марганцевої кислоти, який потім негайно гідролізується до двоатомних спирту – діола. Проміжною сполукою, обумовлюється те, що гідроксильні групи знаходяться в вицинальном становищі – у різних атомів вуглецю. Саме проміжне з’єднання – интермедиат – ніколи не було виділено, однак його наявність підтверджується дослідженнями: при використанні в якості реагенту перманганату з міченим іоном кисню 18O на виході утворюється діол, у складі гідроксильних груп якого виявлялися шукані мічені 18O. Отже, атоми кисню переходять до алкену не з води – розчинника, а від перманганату – окислювача.
Якщо в реакцію Вагнера вводити транс-ізомер алкена, то на виході гідроксильні групи стають в цис-положенні, а у випадку з цис-ізомером алкена утворюється діол з функціональними групами в транс-положенні. Ці стереохімічні співвідношення були виведені емпіричним шляхом і працюють також для реакцій приєднання інших реагентів по кратному зв’язку.
Значення
Реакція окислення по Вагнеру є якісною на кратну зв’язок поряд із жорстким окисленню ненасичених вуглеводнів та бромування. В ході реакції знебарвлюється малиновий розчин перманганату калію і утворюється нерозчинний бурий осад – оксид марганцю(IV). Продукти реакції двохатомні спирти – також називають гликолями. Найбільше практичне значення мають нижчі гліколі на основі етилену, пропілену та бутилену, а також високомолекулярні сполуки-полімери на їх основі, наприклад, поліетиленоксид.

Застосування
Реакція Вагнера, незважаючи на свої обмеження, до цих пір знаходить широке застосування в органічному синтезі. Це обумовлено тим, що альтернативна реакція сін-гідроксилювання алкенів використовує в процесі оксид осмію(VIII), який є токсичним, важкодоступним і дорогим реагентом. Пізніше було запропоновано третій метод сін-гідроксилювання подвійного зв’язку – тристадійний процес з використанням йоду і ацетату срібла, однак реакція Вагнера є найстарішим і найбільш відомим способом м’якого окислення подвійний зв’язку.