Отримання оксидів
Продовжимо розглядати класифікацію, властивості, одержання оксидів. Можна виділити три способи, за допомогою яких сполуки добувають в лабораторії. Найпоширеніший серед них – це окислення простих речовин. Горіння складних сполук, наприклад, природного газу або нафти, – ще один шлях отримання газоподібних оксидів вуглецю і водню. До третього способу ми віднесемо термічне розкладання деяких солей вугільної та нітратної кислот, а також нагрівання нерозчинних у воді підстав, таких як гідроксид міді або заліза. При цьому утворюються оксиди металів і вода.
Взаємодія оксидів між собою
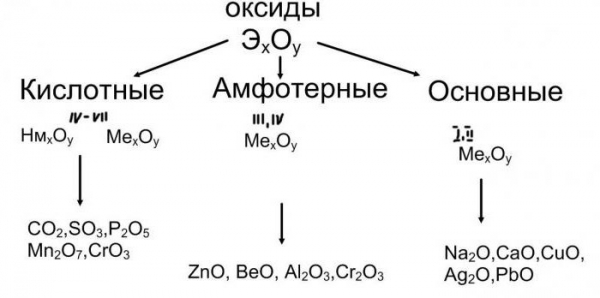
Вивчаючи оксиди, їх класифікацію та хімічні властивості, звернемося до реакцій між речовинами кислотних і основних груп. В результаті їх утворюються сполуки, що відносяться до класу солей. Наприклад, якщо через розчин оксиду кальцію (вапняну воду) пропускати вуглекислий газ, то вона мутніє внаслідок утворення часток нерозчинного карбонату кальцію CaCO3. У промисловості широко застосовують реакції взаємодії кількох речовин: оксидів натрію, кальцію і кремнію. Нагріваючи їх суміш разом з технічною содою, одержують скло.
Особливими характеристиками володіє оксид водню – вода, про них ми поговоримо далі. H2O – найпоширеніше і необхідне з’єднання на Землі. Здатність її молекул до утворення водневих зв’язків забезпечує головні властивості води як універсального розчинника, що володіє специфічними властивостями: високою теплоємністю і теплопровідністю. Вони дуже важливі для процесів обміну речовин в живих організмах.
Вода, як оксид, не реагує з різними кислотними та основними оксидами. У першому випадку отримують кислоти, у другому – луги. Специфічна реакція оксиду водню – здійснювати реакції гідролітичного розкладу (гідролізу). Вони дуже поширені серед речовин органічного походження. Це гідроліз білків, вуглеводів і жирів, що проходить в шлунково-кишковому тракті, розщеплення целюлози мікроорганізмами – сапротрофами і т. д.