Ароматичні вуглеводні, звані ще аренами, представлені органічними речовинами. В складі їх молекул присутні одна або кілька бензольних ядер (кілець). Бензол, також званий бензеном, – перший представник гомологічного ряду аренів. Хімічні властивості, будова молекули та типи хімічних зв’язків в його молекулі мають ряд особливостей. Ми розглянемо їх в нашій статті, а також познайомимося з іншими сполуками, що входять до групи ароматичних вуглеводнів.
Як встановили структурну формулу аренів
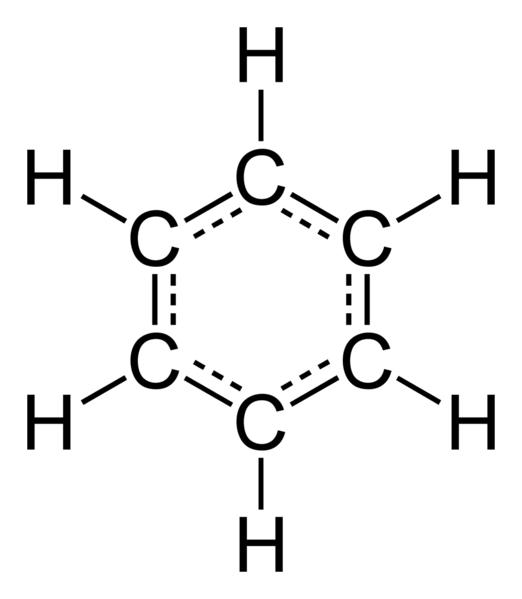
У 1865 році німецький вчений Ф. Кекуле запропонував просторову модель найпростішого арена – бензолу. Вона мала вигляд плоского шестикутника, у вершинах якого перебували атоми вуглецю, які з’єднувалися між собою трьома простими та подвійними зв’язками, що чергуються один з одним. Однак виявлені експериментальним шляхом хімічні властивості аренів не відповідали запропонованої Ф. Кекуле формулою. Наприклад, бензол не обесцвечивал розчин перманганату калію і бромну воду, що вказувало на відсутність в молекулах аренів пі-зв’язків. Яке ж будову бензолу насправді? Ні одинарних, ні подвійних зв’язків у ароматичних вуглеводнів немає. Дослідним шляхом встановлено, що ці сполуки містять між атомами вуглецю рівноцінний тип хімічного зв’язку, що отримала назву полуторним, або ароматичної. Саме тому вони не вступають в реакцію окислення з розчинами KMnO4 і Br2. Виведена загальна формула аренів – c n h 2n-6. Усі специфічні властивості ароматичних сполук можна пояснити їх електронним будовою, яке ми розглянемо далі.