Для виникнення найпростішої біологічної системи в умовах нашої планети достатньо присутності лише двох видів органічних речовин: нуклеїнових кислот і білків. Структура цих сполук має як риси подібності, так і кардинальні відмінності. Наприклад, вони є биополимерами, знаходяться у всіх без винятку клітинах живих організмів. З’єднання під дією негативних факторів можуть змінювати свою нативну структуру – піддаватися денатурації і деструкції. У нашій статті ми розглянемо, яку роль виконують білки в молекулах складних речовин, наприклад, таких як гликопротеиды і ліпопротеїди. Також вивчимо особливості будови глобулярных білків і наведемо приклади різних їх видів.
Будова пептидів
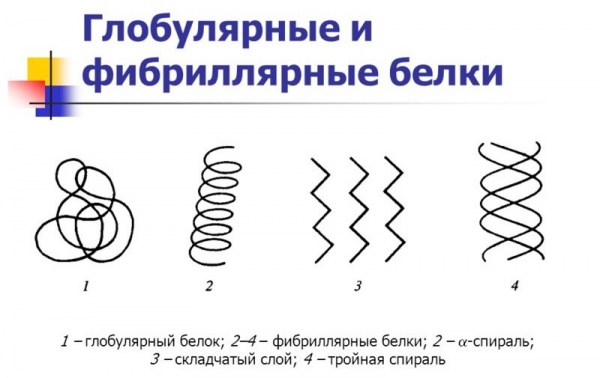
Гігантські розміри білків (у порівнянні з величиною інших клітинних органічних речовин – вуглеводів, жирів, вітамінів і т. д.) пояснюються їх будовою. Всі білки, інакше звані протеїнами, представляють собою складні комплекси – полімери. Вони мають не тільки велику молекулярну масу, але й кілька форм просторового розташування власної макромолекули. Елементарні частинки білкового полімеру – це 20 видів амінокислот, що беруть участь в реакції поліконденсації. Вони з’єднуються між собою за допомогою пептидних зв’язків -CO—NH-, завдяки яким і утворюється найпростіша форма макромолекули. Така структура білків носить назву первинної або лінійної конфігурації. Утворення додаткових, спочатку водневих зв’язків, а потім і дисульфідних містків призводить до появи спіральної та глобулярной форм білка. Третинна конфігурація у формі сферичних молекул – глобул– поширена в живих біосистемах: клітинах, органах, тканинах. Вона може ускладнюватися у вигляді декількох глобул, пов’язаних небелковым компонентом, і утворювати вищу форму організації – четвертинну структуру.